Uranium - Daripada Wikipedia, ensiklopedia percuma
Uranium
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Uranium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Sebutan | / j ʊ ˈ r eɪ n i ə m / ( yuu- RAY -nee-əm ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Penampilan | logam kelabu perak; menghakis kepada lapisan oksida hitam yang mengelupas di udara | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Berat atom piawai A r °(U) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Uranium dalam jadual berkala | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombor atom ( Z ) | 92 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kumpulan | kumpulan blok-f (tiada nombor) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tempoh | tempoh 7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sekat | blok-f | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Konfigurasi elektron | [ Rn ] 5f 3 6d 1 7s 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektron setiap cangkang | 2, 8, 18, 32, 21, 9, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ciri-ciri fizikal | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fasa di STP | padu | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Takat lebur | 1405.3 K (1132.2 °C, 2070 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Takat didih | 4404 K (4131 °C, 7468 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ketumpatan (berhampiran rt ) | 19.1 g/sm 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| apabila cecair (pada mp ) | 17.3 g/sm 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Haba pelakuran | 9.14 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Haba pengewapan | 417.1 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kapasiti haba molar | 27.665 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
Tekanan wap
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sifat atom | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Keadaan pengoksidaan | −1, [2] +1, +2, +3, [3] +4 , +5, +6 ( oksida amfoterik ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Keelektronegatifan | Skala Pauling: 1.38 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tenaga pengionan |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jejari atom | empirikal: 156 petang | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jejari kovalen | 196±7 malam | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jejari Van der Waals | 186 petang | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Harta lain | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kejadian semula jadi | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Struktur kristal | ortorombik | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kelajuan rod nipis bunyi | 3155 m/s (pada 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pengembangan terma | 13.9 µm/(m⋅K) (pada 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kekonduksian terma | 27.5 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kerintangan elektrik | 0.280 µΩ⋅m (pada 0 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pesanan magnet | paramagnet | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Modulus Young | 208 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Modulus ricih | 111 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Modulus pukal | 100 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nisbah Poisson | 0.23 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kekerasan Vickers | 1960–2500 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kekerasan Brinell | 2350–3850 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombor CAS | 7440-61-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sejarah | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Penamaan | selepas planet Uranus , sendiri dinamakan sempena tuhan Yunani langit Uranus | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Penemuan | Martin Heinrich Klaproth (1789) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pengasingan pertama | Eugène-Melchior Péligot (1841) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotop uranium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
Uranium ialah unsur kimia dengan simbol U dan nombor atom 92. Ia adalah logam kelabu keperakan dalam siri aktinida jadual berkala . Atom uranium mempunyai 92 proton dan 92 elektron , di mana 6 daripadanya adalah elektron valens . Uranium secara radioaktif mereput dengan memancarkan zarah alfa . Separuh hayat pereputan ini berbeza-beza antara 159,200 dan 4.5 bilion tahun untuk isotop yang berbeza , menjadikannya berguna untuk menentukan usia Bumi . Isotop yang paling biasa dalamuranium semulajadi ialah uranium-238 (yang mempunyai 146 neutron dan menyumbang lebih daripada 99% uranium di Bumi) dan uranium-235 (yang mempunyai 143 neutron). Uranium mempunyai berat atom tertinggi bagi unsur-unsur asalnya . Ketumpatannya adalah kira-kira 70% lebih tinggi daripada plumbum , dan sedikit lebih rendah daripada emas atau tungsten . Ia berlaku secara semula jadi dalam kepekatan rendah beberapa bahagian per juta dalam tanah, batu dan air, dan diekstrak secara komersil daripada mineral yang mengandungi uranium seperti uraninit .[6]
Banyak kegunaan kontemporari uranium mengeksploitasi sifat nuklearnya yang unik . Uranium-235 adalah satu-satunya isotop fisil yang wujud secara semula jadi , yang menjadikannya digunakan secara meluas dalam loji kuasa nuklear dan senjata nuklear . Walau bagaimanapun, kerana kepekatan uranium-235 yang sangat rendah dalam uranium semulajadi (iaitu, kebanyakannya, kebanyakannya uranium-238), uranium perlu menjalani pengayaan supaya cukup uranium-235 hadir. Uranium-238 boleh dibelah oleh neutron pantas, dan subur , bermakna ia boleh ditukar kepada plutonium-239 fisil dalam reaktor nuklear . Satu lagi isotop fisil,uranium-233 , boleh dihasilkan daripada torium semula jadi dan dikaji untuk kegunaan industri masa hadapan dalam teknologi nuklear. Uranium-238 mempunyai kebarangkalian kecil untuk pembelahan spontan atau pembelahan teraruh dengan neutron pantas; uranium-235, dan pada tahap yang lebih rendah uranium-233, mempunyai keratan rentas pembelahan yang lebih tinggi untuk neutron perlahan. Dalam kepekatan yang mencukupi, isotop ini mengekalkan tindak balas rantai nuklear yang berterusan . Ini menjana haba dalam reaktor kuasa nuklear, dan menghasilkan bahan fisil untuk senjata nuklear. Uranium habis ( 238 U) digunakan dalam penembus tenaga kinetik dan penyaduran perisai . [7] [8]
Penemuan uranium pada tahun 1789 dalam adunan galian dikreditkan kepada Martin Heinrich Klaproth , yang menamakan unsur baharu itu sempena planet Uranus yang baru ditemui . Eugène-Melchior Péligot ialah orang pertama yang mengasingkan logam dan sifat radioaktifnya ditemui pada tahun 1896 oleh Henri Becquerel . Penyelidikan oleh Otto Hahn , Lise Meitner , Enrico Fermi dan lain-lain, seperti J. Robert Oppenheimer bermula pada tahun 1934 membawa kepada penggunaannya sebagai bahan api dalam industri tenaga nuklear dan dalam Little Boy ,senjata nuklear pertama yang digunakan dalam peperangan . Perlumbaan senjata yang berlaku semasa Perang Dingin antara Amerika Syarikat dan Kesatuan Soviet menghasilkan puluhan ribu senjata nuklear yang menggunakan logam uranium dan plutonium-239 yang berasal dari uranium . Pembongkaran senjata ini dan kemudahan nuklear yang berkaitan dijalankan dalam pelbagai program pelucutan senjata nuklear dan menelan belanja berbilion dolar. Uranium gred senjata yang diperoleh daripada senjata nuklear dicairkan dengan uranium-238 dan digunakan semula sebagai bahan api untuk reaktor nuklear. Pembangunan dan penggunaan reaktor nuklear ini diteruskan di pangkalan global kerana ia merupakan sumber CO 2 yang berkuasa-tenaga bebas. Bahan api nuklear yang dibelanjakan membentuk sisa radioaktif , yang kebanyakannya terdiri daripada uranium-238 dan menimbulkan ancaman kesihatan dan kesan alam sekitar yang ketara .
Ciri-ciri

Uranium ialah logam radioaktif berwarna putih keperakan dan lemah . Ia mempunyai kekerasan Mohs 6, cukup untuk mencalar kaca dan lebih kurang sama dengan titanium , rhodium , mangan dan niobium . Ia boleh ditempa , mulur , sedikit paramagnet , sangat elektropositif dan pengalir elektrik yang lemah . [9] [10] Logam uranium mempunyai ketumpatan yang sangat tinggi iaitu 19.1 g/cm 3 , [11] lebih tumpat daripada plumbum (11.3 g/cm 3 ),[12] tetapi kurang tumpat sedikit daripada tungsten dan emas (19.3 g/cm 3 ). [13] [14]
Uranium metal reacts with almost all non-metal elements (with the exception of the noble gases) and their compounds, with reactivity increasing with temperature.[15] Hydrochloric and nitric acids dissolve uranium, but non-oxidizing acids other than hydrochloric acid attack the element very slowly.[9] When finely divided, it can react with cold water; in air, uranium metal becomes coated with a dark layer of uranium oxide.[10] Uranium in ores is extracted chemically and converted into uranium dioxide or other chemical forms usable in industry.
Uranium-235 was the first isotope that was found to be fissile. Other naturally occurring isotopes are fissionable, but not fissile. On bombardment with slow neutrons, its uranium-235 isotope will most of the time divide into two smaller nuclei, releasing nuclear binding energy and more neutrons. If too many of these neutrons are absorbed by other uranium-235 nuclei, a nuclear chain reaction occurs that results in a burst of heat or (in special circumstances) an explosion. In a nuclear reactor, such a chain reaction is slowed and controlled by a neutron poison, absorbing some of the free neutrons. Such neutron absorbent materials are often part of reactor control rods (see nuclear reactor physics for a description of this process of reactor control).
As little as 15 lb (6.8 kg) of uranium-235 can be used to make an atomic bomb.[16] The nuclear weapon detonated over Hiroshima, called Little Boy, relied on uranium fission. However, the first nuclear bomb (the Gadget used at Trinity) and the bomb that was detonated over Nagasaki (Fat Man) were both plutonium bombs.
Uranium metal has three allotropic forms:[17]
- α ( ortorombik ) stabil sehingga 668 °C (1,234 °F). Orthorhombic, kumpulan ruang No. 63, Cmcm , parameter kekisi a = 285.4 pm, b = 587 pm, c = 495.5 pm. [18]
- β ( tetragonal ) stabil dari 668 hingga 775 °C (1,234 hingga 1,427 °F). Tetragonal, kumpulan ruang P 4 2 / mnm , P 4 2 nm , atau P 4 n 2, parameter kekisi a = 565.6 pm, b = c = 1075.9 pm. [18]
- γ ( kubik berpusat badan ) daripada 775 °C (1,427 °F) hingga takat lebur—ini ialah keadaan paling mudah ditempa dan mulur. Kubik berpusat badan, parameter kekisi a = 352.4 petang. [18]
Aplikasi
tentera

Aplikasi utama uranium dalam sektor ketenteraan adalah dalam penembus berketumpatan tinggi. Peluru ini terdiri daripada uranium (DU) yang habis dialoi dengan 1–2% unsur lain, seperti titanium atau molibdenum . [19] Pada kelajuan hentaman tinggi, ketumpatan, kekerasan, dan kepiroforisitas peluru membolehkan pemusnahan sasaran berperisai berat. Perisai kereta kebal dan perisai kenderaan boleh tanggal lain juga boleh dikeraskan dengan plat uranium yang telah habis. Penggunaan uranium yang habis menjadi perbalahan politik dan alam sekitar selepas penggunaan senjata sedemikian oleh AS, UK dan negara lain semasa peperangan di Teluk Parsi dan Balkan menimbulkan persoalan mengenai sebatian uranium yang ditinggalkan di dalam tanah.[8] [20] [21] [22] (lihat sindrom Perang Teluk ). [16]
Uranium yang habis juga digunakan sebagai bahan perisai dalam beberapa bekas yang digunakan untuk menyimpan dan mengangkut bahan radioaktif. Walaupun logam itu sendiri adalah radioaktif, ketumpatannya yang tinggi menjadikannya lebih berkesan daripada plumbum dalam menghentikan sinaran daripada sumber yang kuat seperti radium . [9] Kegunaan lain uranium yang habis termasuk pengimbang untuk permukaan kawalan pesawat, sebagai pemberat untuk kenderaan kemasukan semula peluru berpandu dan sebagai bahan perisai. [10] Oleh kerana ketumpatannya yang tinggi, bahan ini terdapat dalam sistem bimbingan inersia dan dalam kompas giroskopik . [10]Uranium yang habis diutamakan berbanding logam yang sama padat kerana kebolehannya untuk dimesin dan dituang dengan mudah serta kosnya yang agak rendah. [23] Risiko utama pendedahan kepada uranium yang habis ialah keracunan kimia oleh uranium oksida dan bukannya radioaktiviti (uranium hanyalah pemancar alfa yang lemah ).
Semasa peringkat akhir Perang Dunia II , keseluruhan Perang Dingin , dan pada tahap yang lebih rendah selepas itu, uranium-235 telah digunakan sebagai bahan letupan fisil untuk menghasilkan senjata nuklear. Pada mulanya, dua jenis utama bom pembelahan telah dibina: peranti yang agak mudah yang menggunakan uranium-235 dan mekanisme yang lebih rumit yang menggunakan plutonium-239 yang diperolehi daripada uranium-238. Kemudian, jenis bom pembelahan/pelaburan yang jauh lebih rumit dan lebih berkuasa ( senjata termonuklear ) telah dibina, yang menggunakan peranti berasaskan plutonium untuk menyebabkan campuran tritium dan deuterium menjalani pelakuran nuklear. Bom sedemikian disaluti dalam bekas uranium bukan fisil (tidak diperkaya), dan ia memperoleh lebih daripada separuh kuasanya daripada pembelahan bahan ini oleh neutron pantas daripada proses pelakuran nuklear. [24]
orang awam
Penggunaan utama uranium dalam sektor awam adalah untuk bahan api loji tenaga nuklear . Satu kilogram uranium-235 secara teorinya boleh menghasilkan kira-kira 20 terajoule tenaga (2 × 1013 joule ), dengan mengandaikan pembelahan lengkap; tenaga sebanyak1.5 juta kilogram (1,500 tan ) arang batu . [7]
Loji kuasa nuklear komersial menggunakan bahan api yang biasanya diperkaya kepada sekitar 3% uranium-235. [7] Reka bentuk CANDU dan Magnox adalah satu-satunya reaktor komersial yang mampu menggunakan bahan api uranium yang tidak diperkaya . Bahan api yang digunakan untuk reaktor Tentera Laut Amerika Syarikat biasanya sangat diperkaya dalam uranium-235 (nilai yang tepat dikelaskan ). Dalam reaktor pembiakan , uranium-238 juga boleh ditukar menjadi plutonium melalui tindak balas berikut: [10]

Sebelum (dan, kadangkala, selepas) penemuan radioaktiviti, uranium digunakan terutamanya dalam jumlah kecil untuk kaca kuning dan kaca tembikar, seperti kaca uranium dan dalam Fiestaware . [25]
Penemuan dan pengasingan radium dalam bijih uranium (pitchblende) oleh Marie Curie mencetuskan perkembangan perlombongan uranium untuk mengekstrak radium, yang digunakan untuk membuat cat bercahaya-dalam-gelap untuk jam dan dail pesawat. [26] [27] Ini meninggalkan kuantiti uranium yang banyak sebagai bahan buangan, kerana ia memerlukan tiga tan uranium untuk mengekstrak satu gram radium. Bahan buangan ini dialihkan kepada industri kaca, menjadikan kaca uranium sangat murah dan banyak. Selain kaca tembikar, kaca jubin uranium menyumbang sebahagian besar penggunaannya, termasuk jubin bilik mandi dan dapur biasa yang boleh dihasilkan dalam warna hijau, kuning, ungu muda , hitam, biru, merah dan warna lain.


Uranium juga digunakan dalam bahan kimia fotografi (terutama uranium nitrat sebagai toner ), [10] dalam filamen lampu untuk mentol lampu pentas , [28] untuk memperbaiki penampilan gigi palsu , [29] dan dalam industri kulit dan kayu untuk kotoran dan pewarna. Garam uranium adalah mordan sutera atau bulu. Uranil asetat dan format uranil digunakan sebagai "noda" padat elektron dalam mikroskop elektron penghantaran , untuk meningkatkan kontras spesimen biologi dalam bahagian ultranipis dan dalam pewarnaan negatif virus , terpencilorganel sel dan makromolekul .
Penemuan keradioaktifan uranium membawa kepada penggunaan saintifik dan praktikal tambahan bagi unsur tersebut. Separuh hayat panjang isotop uranium-238 (4.47 × 109 tahun) menjadikannya sangat sesuai untuk digunakan dalam menganggarkan umur batuan igneus terawal dan untuk jenis pentarikhan radiometrik yang lain , termasuk pentarikhan uranium-torium , pentarikhan uranium-plumbum dan pentarikhan uranium-uranium . Logam uranium digunakan untuk sasaran sinar-X dalam pembuatan sinar-X bertenaga tinggi. [10]
Sejarah
Penggunaan pra-penemuan
The use of uranium in its natural oxide form dates back to at least the year 79 CE, when it was used in the Roman Empire to add a yellow color to ceramic glazes.[10] Yellow glass with 1% uranium oxide was found in a Roman villa on Cape Posillipo in the Bay of Naples, Italy, by R. T. Gunther of the University of Oxford in 1912.[30] Starting in the late Middle Ages, pitchblende was extracted from the Habsburg silver mines in Joachimsthal, Bohemia (now Jáchymov in the Czech Republic), and was used as a coloring agent in the local glassmaking industry.[31] In the early 19th century, the world's only known sources of uranium ore were these mines. Mining for uranium in the Ore Mountains ceased on the German side after the Cold War ended and SDAG Wismut was wound down. On the Czech side there were attempts during the uranium price bubble of 2007 to restart mining, but those were quickly abandoned following a fall in uranium prices.[32][33]
Discovery

The discovery of the element is credited to the German chemist Martin Heinrich Klaproth. While he was working in his experimental laboratory in Berlin in 1789, Klaproth was able to precipitate a yellow compound (likely sodium diuranate) by dissolving pitchblende in nitric acid and neutralizing the solution with sodium hydroxide.[31] Klaproth assumed the yellow substance was the oxide of a yet-undiscovered element and heated it with charcoal to obtain a black powder, which he thought was the newly discovered metal itself (in fact, that powder was an oxide of uranium).[31][34] He named the newly discovered element after the planet Uranus (named after the primordial Greek god of the sky), which had been discovered eight years earlier by William Herschel.[35]
In 1841, Eugène-Melchior Péligot, Professor of Analytical Chemistry at the Conservatoire National des Arts et Métiers (Central School of Arts and Manufactures) in Paris, isolated the first sample of uranium metal by heating uranium tetrachloride with potassium.[31][36]

Henri Becquerel discovered radioactivity by using uranium in 1896.[15] Becquerel made the discovery in Paris by leaving a sample of a uranium salt, K2UO2(SO4)2 (potassium uranyl sulfate), on top of an unexposed photographic plate in a drawer and noting that the plate had become "fogged".[37] He determined that a form of invisible light or rays emitted by uranium had exposed the plate.
During World War I when the Central Powers suffered a shortage of molybdenum to make artillery gun barrels and high speed tool steels, they routinely used ferrouranium alloy as a substitute, as it presents many of the same physical characteristics as molybdenum. When this practice became known in 1916 the US government requested several prominent universities to research the use of uranium in manufacturing and metalwork. Tools made with these formulas remained in use for several decades,[38][39] until the Manhattan Project and the Cold War placed a large demand on uranium for fission research and weapon development.
Fission research

A team led by Enrico Fermi in 1934 observed that bombarding uranium with neutrons produces the emission of beta rays (electrons or positrons from the elements produced; see beta particle).[40] The fission products were at first mistaken for new elements with atomic numbers 93 and 94, which the Dean of the Faculty of Rome, Orso Mario Corbino, christened ausonium and hesperium, respectively.[41][42][43][44] The experiments leading to the discovery of uranium's ability to fission (break apart) into lighter elements and release binding energy were conducted by Otto Hahn and Fritz Strassmann[40] in Hahn's laboratory in Berlin. Lise Meitner and her nephew, the physicist Otto Robert Frisch, published the physical explanation in February 1939 and named the process "nuclear fission".[45] Soon after, Fermi hypothesized that the fission of uranium might release enough neutrons to sustain a fission reaction. Confirmation of this hypothesis came in 1939, and later work found that on average about 2.5 neutrons are released by each fission of the rare uranium isotope uranium-235.[40] Fermi urged Alfred O. C. Nier to separate uranium isotopes for determination of the fissile component, and on 29 February 1940, Nier used an instrument he built at the University of Minnesota to separate the world's first uranium-235 sample in the Tate Laboratory. Using Columbia University's cyclotron, John Dunning confirmed the sample to be the isolated fissile material on 1 March.[46] Further work found that the far more common uranium-238 isotope can be transmuted into plutonium, which, like uranium-235, is also fissile by thermal neutrons. These discoveries led numerous countries to begin working on the development of nuclear weapons and nuclear power. Despite fission having been discovered in Germany, the Uranverein ("uranium club") Germany's wartime project to research nuclear power and/or weapons was hampered by limited resources, infighting, the exile or non-involvement of several prominent scientists in the field and several crucial mistakes such as failing to account for impurities in available graphite samples which made it appear less suitable as a neutron moderator than it is in reality. Germany's attempts to build a natural uranium / heavy water reactor had not come close to reaching criticality by the time the Americans reached Haigerloch, the site of the last German wartime reactor experiment.[47]
On 2 December 1942, as part of the Manhattan Project, another team led by Enrico Fermi was able to initiate the first artificial self-sustained nuclear chain reaction, Chicago Pile-1. An initial plan using enriched uranium-235 was abandoned as it was as yet unavailable in sufficient quantities.[48] Working in a lab below the stands of Stagg Field at the University of Chicago, the team created the conditions needed for such a reaction by piling together 360 tonnes of graphite, 53 tonnes of uranium oxide, and 5.5 tonnes of uranium metal, a majority of which was supplied by Westinghouse Lamp Plant in a makeshift production process.[40][49]
Nuclear weaponry

Two major types of atomic bombs were developed by the United States during World War II: a uranium-based device (codenamed "Little Boy") whose fissile material was highly enriched uranium, and a plutonium-based device (see Trinity test and "Fat Man") whose plutonium was derived from uranium-238. The uranium-based Little Boy device became the first nuclear weapon used in war when it was detonated over the Japanese city of Hiroshima on 6 August 1945. Exploding with a yield equivalent to 12,500 tonnes of trinitrotoluene, letupan dan gelombang haba bom memusnahkan hampir 50,000 bangunan dan membunuh kira-kira 75,000 orang (lihat pengeboman Atom di Hiroshima dan Nagasaki ). [37] Pada mulanya dipercayai bahawa uranium agak jarang berlaku, dan percambahan nuklear boleh dielakkan dengan hanya membeli semua stok uranium yang diketahui, tetapi dalam tempoh sedekad deposit besar daripadanya ditemui di banyak tempat di seluruh dunia. [50] [51]
Reaktor

Reaktor Grafit X-10 di Makmal Kebangsaan Oak Ridge (ORNL) di Oak Ridge, Tennessee, dahulunya dikenali sebagai Clinton Pile dan X-10 Pile, ialah reaktor nuklear buatan kedua di dunia (selepas Enrico Fermi's Chicago Pile) dan merupakan yang pertama reaktor direka dan dibina untuk operasi berterusan. Reaktor Pembiak Eksperimen I Makmal Kebangsaan Argonne , yang terletak di Stesen Ujian Reaktor Kebangsaan Suruhanjaya Tenaga Atom berhampiran Arco, Idaho , menjadi reaktor nuklear pertama yang mencipta tenaga elektrik pada 20 Disember 1951. [52]Pada mulanya, empat mentol lampu 150 watt dinyalakan oleh reaktor, tetapi penambahbaikan akhirnya membolehkannya membekalkan tenaga kepada keseluruhan kemudahan (kemudian, bandar Arco menjadi yang pertama di dunia yang mempunyai semua tenaga elektriknya berasal daripada kuasa nuklear yang dijana oleh BORAX- III , satu lagi reaktor yang direka dan dikendalikan oleh Argonne National Laboratory ). [53] [54] Stesen janakuasa nuklear berskala komersial pertama di dunia, Obninsk di Kesatuan Soviet , memulakan penjanaan dengan reaktor AM-1 pada 27 Jun 1954. Loji kuasa nuklear awal yang lain ialah Calder Hall di England, yang memulakan penjanaan pada 17 Oktober 1956, [55] danStesen Janakuasa Atom Shippingport di Pennsylvania , yang bermula pada 26 Mei 1958. Kuasa nuklear digunakan buat kali pertama untuk pendorongan oleh kapal selam , USS Nautilus , pada tahun 1954. [40] [56]
Pembelahan semula jadi prasejarah
Pada tahun 1972, ahli fizik Perancis Francis Perrin menemui lima belas reaktor pembelahan nuklear semula jadi purba dan tidak lagi aktif dalam tiga deposit bijih berasingan di lombong Oklo di Gabon , Afrika Barat , secara kolektif dikenali sebagai Reaktor Fosil Oklo . Deposit bijih berumur 1.7 bilion tahun; kemudian, uranium-235 membentuk kira-kira 3% daripada jumlah uranium di Bumi. [57] Ini cukup tinggi untuk membenarkan tindak balas rantai pembelahan nuklear yang berterusan berlaku, dengan syarat keadaan sokongan lain wujud. Kapasiti sedimen di sekeliling untuk mengandungi sisa nuklear yang mengancam kesihatanproduk telah dipetik oleh kerajaan persekutuan AS sebagai bukti sokongan untuk kemungkinan menyimpan bahan api nuklear yang dibelanjakan di repositori sisa nuklear Gunung Yucca . [57]
Pencemaran dan warisan Perang Dingin
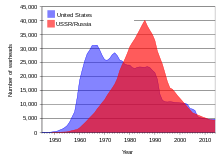
Ujian nuklear atas tanah oleh Kesatuan Soviet dan Amerika Syarikat pada tahun 1950-an dan awal 1960-an dan oleh Perancis pada 1970-an dan 1980-an [23] menyebarkan sejumlah besar kejatuhan daripada isotop anak uranium ke seluruh dunia. [58] Kejatuhan dan pencemaran tambahan berlaku daripada beberapa kemalangan nuklear . [59]
Pelombong uranium mempunyai insiden kanser yang lebih tinggi . Risiko berlebihan kanser paru-paru di kalangan pelombong uranium Navajo , sebagai contoh, telah didokumenkan dan dikaitkan dengan pekerjaan mereka. [60] Akta Pampasan Pendedahan Sinaran , undang-undang 1990 di AS, memerlukan $100,000 sebagai "bayaran belas kasihan" kepada pelombong uranium yang didiagnosis dengan kanser atau penyakit pernafasan lain. [61]
Semasa Perang Dingin antara Kesatuan Soviet dan Amerika Syarikat, simpanan uranium yang besar telah dikumpulkan dan berpuluh-puluh ribu senjata nuklear dicipta menggunakan uranium dan plutonium yang diperkaya yang diperbuat daripada uranium. Selepas pemecahan Kesatuan Soviet pada tahun 1991, dianggarkan 600 tan pendek (540 tan metrik) uranium gred senjata yang sangat diperkaya (cukup untuk membuat 40,000 kepala peledak nuklear) telah disimpan dalam kemudahan yang sering tidak dikawal di Persekutuan Rusia dan beberapa negara bekas Soviet yang lain. [16] Polis di Asia , Eropah , dan Amerika Selatan sekurang-kurangnya 16 kali dari 1993 hingga 2005 telah memintas penghantaranuranium gred bom atau plutonium yang diseludup, kebanyakannya daripada sumber bekas Soviet. [16] Dari 1993 hingga 2005, Program Perlindungan, Kawalan dan Perakaunan Bahan, yang dikendalikan oleh kerajaan persekutuan Amerika Syarikat , membelanjakan kira-kira AS $ 550 juta untuk membantu melindungi simpanan uranium dan plutonium di Rusia. Wang ini digunakan untuk penambahbaikan dan peningkatan keselamatan di kemudahan penyelidikan dan penyimpanan. [16]
Keselamatan kemudahan nuklear di Rusia telah meningkat dengan ketara sejak penstabilan kegawatan politik dan ekonomi pada awal 1990-an. Sebagai contoh, pada tahun 1993 terdapat 29 insiden yang berada di atas tahap 1 pada Skala Peristiwa Nuklear Antarabangsa , dan jumlah ini menurun di bawah empat setiap tahun pada 1995–2003. Bilangan majikan yang menerima dos sinaran tahunan melebihi 20 mSv , yang bersamaan dengan satu imbasan CT seluruh badan , [62]menyaksikan kemerosotan kukuh sekitar 2000. Pada November 2015, kerajaan Rusia meluluskan program persekutuan untuk keselamatan nuklear dan sinaran untuk 2016 hingga 2030 dengan bajet 562 bilion rubel (kira-kira 8 bilion dolar). Isu utamanya ialah "liabiliti tertunda yang terkumpul selama 70 tahun industri nuklear, terutamanya semasa zaman Kesatuan Soviet". Kira-kira 73% daripada bajet akan dibelanjakan untuk menyahtauliah reaktor nuklear dan kemudahan nuklear yang sudah tua dan usang, terutamanya yang terlibat dalam program pertahanan negara; 20% akan digunakan dalam pemprosesan dan pelupusan bahan api nuklear dan sisa radioaktif, dan 5% untuk memantau dan memastikan keselamatan nuklear dan sinaran. [63]
Kejadian
asal usul
Bersama dengan semua unsur yang mempunyai berat atom lebih tinggi daripada besi , uranium hanya terbentuk secara semula jadi oleh proses r (penangkapan neutron pantas) dalam supernova dan penggabungan bintang neutron . [64] Torium dan uranium primordial hanya dihasilkan dalam proses r, kerana proses s (penangkapan neutron perlahan) terlalu perlahan dan tidak boleh melepasi jurang ketidakstabilan selepas bismut. [65] [66] Selain dua isotop uranium primordial yang masih ada, 235 U dan 238 U, proses r juga menghasilkan kuantiti yang ketara sebanyak 236 U., yang mempunyai separuh hayat yang lebih pendek dan begitu juga dengan radionuklid yang telah pupus , yang telah lama mereput sepenuhnya hingga 232 Th. Uranium-236 sendiri diperkaya oleh pereputan 244 Pu , menyumbang kepada kelimpahan torium yang lebih tinggi daripada yang dijangkakan dan kelimpahan uranium yang lebih rendah daripada yang dijangkakan. [67] Manakala kelimpahan semula jadi uranium telah ditambah dengan pereputan pupus 242 Pu (separuh hayat 0.375 juta tahun) dan 247 Cm (separuh hayat 16 juta tahun), menghasilkan 238 U dan 235U masing-masing, ini berlaku pada tahap yang hampir boleh diabaikan disebabkan oleh separuh hayat yang lebih pendek ibu bapa ini dan pengeluaran mereka yang lebih rendah daripada 236 U dan 244 Pu, ibu bapa torium: nisbah 247 Cm: 235 U semasa pembentukan Sistem Suria adalah(7.0 ± 1.6) × 10 −5 . [68]
Biotik dan abiotik


Uranium ialah unsur semula jadi yang boleh didapati dalam paras rendah dalam semua batu, tanah dan air. Uranium ialah unsur ke-51 dalam susunan kelimpahan dalam kerak bumi. Uranium juga merupakan unsur bernombor tertinggi yang ditemui secara semula jadi dalam kuantiti yang ketara di Bumi dan hampir selalu dijumpai digabungkan dengan unsur lain. [10] Pereputan uranium, torium , dan kalium-40 dalam mantel Bumi dianggap sebagai sumber utama haba [69] [70] yang mengekalkan teras luar Bumi dalam keadaan cair dan mendorong perolakan mantel , yang dalam giliran memandu plat tektonik.
Uranium's average concentration in the Earth's crust is (depending on the reference) 2 to 4 parts per million,[9][23] or about 40 times as abundant as silver.[15] The Earth's crust from the surface to 25 km (15 mi) down is calculated to contain 1017 kg (2×1017 lb) of uranium while the oceans may contain 1013 kg (2×1013 lb).[9] The concentration of uranium in soil ranges from 0.7 to 11 parts per million (up to 15 parts per million in farmland soil due to use of phosphate fertilizers),[71] and its concentration in sea water is 3 parts per billion.[23]
Uranium is more plentiful than antimony, tin, cadmium, mercury, or silver, and it is about as abundant as arsenic or molybdenum.[10][23] Uranium is found in hundreds of minerals, including uraninite (the most common uranium ore), carnotite, autunite, uranophane, torbernite, and coffinite.[10] Significant concentrations of uranium occur in some substances such as phosphate rock deposits, and minerals such as lignite, and monazite sands in uranium-rich ores[10] (it is recovered commercially from sources with as little as 0.1% uranium[15]).
Sesetengah bakteria, seperti Shewanella putrefaciens , Geobacter metallireducens dan beberapa strain Burkholderia fungorum , menggunakan uranium untuk pertumbuhannya dan menukar U(VI) kepada U(IV). [72] [73] Penyelidikan terkini mencadangkan bahawa laluan ini termasuk pengurangan U(VI) larut melalui keadaan pentavalen U(V) perantaraan. [74] [75] Organisma lain, seperti lichen Trapelia involuta atau mikroorganisma seperti bakteria Citrobacter , boleh menyerap kepekatan uranium sehingga 300 kali ganda paras persekitarannya. [76] Spesies Citrobacter menyerapion uranil apabila diberi gliserol fosfat (atau fosfat organik lain yang serupa). Selepas satu hari, satu gram bakteria boleh mengerakkan diri mereka dengan sembilan gram kristal uranil fosfat; ini mewujudkan kemungkinan bahawa organisma ini boleh digunakan dalam bioremediasi untuk menyahcemar air tercemar uranium. [31] [77] Proteobacterium Geobacter juga telah ditunjukkan untuk membioremediate uranium dalam air tanah. [78] Kulat mikoriza Glomus intraradices meningkatkan kandungan uranium dalam akar tumbuhan simbiotiknya. [79]
Secara semula jadi, uranium(VI) membentuk kompleks karbonat yang sangat larut pada pH alkali. Ini membawa kepada peningkatan dalam mobiliti dan ketersediaan uranium kepada air bawah tanah dan tanah daripada sisa nuklear yang membawa kepada bahaya kesihatan. Walau bagaimanapun, sukar untuk memendakan uranium sebagai fosfat dengan kehadiran karbonat berlebihan pada pH alkali. A Sphingomonas sp. terikan BSAR-1 didapati mengekspresikan alkali fosfatase (PhoK) aktiviti tinggi yang telah digunakan untuk pemendakan bio uranium sebagai spesies uranil fosfat daripada larutan alkali. Keupayaan pemendakan telah dipertingkatkan dengan mengekspresikan protein PhoK secara berlebihan dalam E. coli . [80]
Tumbuhan menyerap sedikit uranium daripada tanah. Kepekatan berat kering uranium dalam tumbuhan berkisar antara 5 hingga 60 bahagian per bilion, dan abu daripada kayu terbakar boleh mempunyai kepekatan sehingga 4 bahagian per juta. [31] Kepekatan berat kering uranium dalam tumbuhan makanan lazimnya lebih rendah dengan satu hingga dua mikrogram sehari ditelan melalui makanan yang dimakan oleh orang ramai. [31]
Pengeluaran dan perlombongan
Pengeluaran uranium di seluruh dunia pada tahun 2021 berjumlah 48,332 tan , di mana 21,819 t (45%) telah dilombong di Kazakhstan . Negara perlombongan uranium penting lain ialah Namibia (5,753 t), Kanada (4,693 t), Australia (4,192 t), Uzbekistan (3,500 t), dan Rusia (2,635 t). [81]
Bijih uranium dilombong dalam beberapa cara: dengan lubang terbuka , bawah tanah , larut lesap in-situ , dan perlombongan lubang gerudi (lihat perlombongan uranium ). [7] Bijih uranium gred rendah yang dilombong biasanya mengandungi 0.01 hingga 0.25% uranium oksida. Langkah-langkah yang meluas mesti diambil untuk mengekstrak logam daripada bijihnya. [82] Bijih gred tinggi yang ditemui dalam deposit Lembangan Athabasca di Saskatchewan , Kanada boleh mengandungi sehingga 23% oksida uranium secara purata. [83] Bijih uranium dihancurkan dan dijadikan serbuk halus dan kemudian dilarutkan sama ada dengan asid atau alkali . Air larut lesap itutertakluk kepada salah satu daripada beberapa urutan pemendakan, pengekstrakan pelarut, dan pertukaran ion. Campuran yang terhasil, dipanggil kek kuning , mengandungi sekurang-kurangnya 75% uranium oksida U 3 O 8 . Yellowcake kemudiannya dikalsinkan untuk membuang kekotoran daripada proses pengilangan sebelum ditapis dan ditukar. [84]
Uranium gred komersial boleh dihasilkan melalui pengurangan uranium halida dengan logam alkali atau alkali tanah . [10] Logam uranium juga boleh disediakan melalui elektrolisis KUF
5atau UF
4, dilarutkan dalam kalsium klorida cair ( Ca Cl
2) dan larutan natrium klorida ( Na Cl). [10] Uranium yang sangat tulen dihasilkan melalui penguraian terma uranium halida pada filamen panas. [10]
Sumber dan rizab

Dianggarkan bahawa 6.1 juta tan uranium wujud dalam rizab bijih yang berdaya maju dari segi ekonomi pada AS$130 per kg uranium, [86] manakala 35 juta tan dikelaskan sebagai sumber mineral (prospek yang munasabah untuk pengekstrakan ekonomi akhirnya). [87]
Australia mempunyai 28% daripada rizab bijih uranium yang diketahui di dunia [86] dan deposit uranium tunggal terbesar di dunia terletak di Lombong Empangan Olimpik di Australia Selatan . [88] Terdapat rizab uranium yang ketara di Bakouma , sub-wilayah di wilayah Mbomou di Republik Afrika Tengah . [89]
Sesetengah uranium juga berasal daripada senjata nuklear yang telah dibongkar. [90] Contohnya, pada 1993–2013 Rusia membekalkan Amerika Syarikat dengan 15,000 tan uranium diperkaya rendah dalam Program Megatons to Megawatts . [91]
Tambahan 4.6 bilion tan uranium dianggarkan akan dilarutkan dalam air laut ( saintis Jepun pada 1980-an menunjukkan bahawa pengekstrakan uranium daripada air laut menggunakan penukar ion secara teknikal boleh dilaksanakan). [92] [93] Terdapat eksperimen untuk mengekstrak uranium daripada air laut, [94] tetapi hasil telah rendah disebabkan oleh karbonat yang terdapat dalam air. Pada tahun 2012, ORNLpenyelidik mengumumkan kejayaan pembangunan bahan penyerap baharu yang digelar HiCap yang melakukan pengekalan permukaan molekul pepejal atau gas, atom atau ion dan juga berkesan membuang logam toksik daripada air, menurut keputusan yang disahkan oleh penyelidik di Pacific Northwest National Laboratory. [95] [96]
Bekalan

Pada tahun 2005, sepuluh negara menyumbang sebahagian besar uranium oksida pekat dunia: Kanada (27.9%), Australia (22.8%), Kazakhstan (10.5%), Rusia (8.0%), Namibia (7.5%), Niger (7.4%). ), Uzbekistan (5.5%), Amerika Syarikat (2.5%), Argentina (2.1%) dan Ukraine (1.9%). [98] Pada tahun 2008 Kazakhstan diramalkan akan meningkatkan pengeluaran dan menjadi pembekal uranium terbesar di dunia menjelang 2009. [99] [100]Ramalan itu menjadi kenyataan, dan Kazakhstan menguasai pasaran uranium dunia sejak 2010. Pada 2021, bahagiannya ialah 45.1%, diikuti oleh Namibia (11.9%), Kanada (9.7%), Australia (8.7%), Uzbekistan (7.2%) , Niger (4.7%), Rusia (5.5%), China (3.9%), India (1.3%), Ukraine (0.9%) dan Afrika Selatan (0.8%), dengan jumlah pengeluaran dunia sebanyak 48,332 tan. [81] Kebanyakan uranium dihasilkan bukan melalui perlombongan bijih bawah tanah konvensional (29% daripada pengeluaran), tetapi melalui larut lesap in situ (66%). [81] [101]
Pada akhir 1960-an, ahli geologi PBB juga menemui deposit uranium utama dan rizab galian yang jarang ditemui di Somalia . Penemuan itu adalah yang terbesar seumpamanya, dengan pakar industri menganggarkan deposit pada lebih 25% daripada rizab uranium yang diketahui dunia ketika itu sebanyak 800,000 tan. [102]
Bekalan muktamad yang ada dipercayai mencukupi untuk sekurang-kurangnya 85 tahun akan datang, [87] walaupun beberapa kajian menunjukkan kekurangan pelaburan pada akhir abad kedua puluh mungkin menghasilkan masalah bekalan pada abad ke-21. [103] Deposit uranium nampaknya teragih log-normal. Terdapat peningkatan 300 kali ganda dalam jumlah uranium yang boleh dipulihkan untuk setiap penurunan sepuluh kali ganda dalam gred bijih. [104] Dalam erti kata lain, terdapat sedikit bijih gred tinggi dan secara proporsional lebih banyak bijih gred rendah tersedia.
sebatian
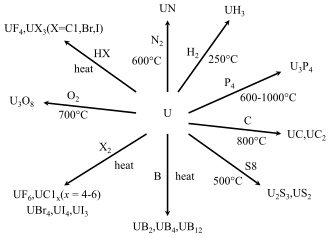
Keadaan pengoksidaan dan oksida
Oksida
Kek kuning uranium terkalsin, seperti yang dihasilkan di banyak kilang besar, mengandungi taburan spesies pengoksidaan uranium dalam pelbagai bentuk daripada yang paling teroksida hingga paling teroksida. Zarah dengan masa tinggal yang singkat dalam calciner secara amnya akan kurang teroksida berbanding zarah yang mempunyai masa pengekalan yang lama atau zarah yang diperoleh semula dalam penyental tindanan. Kandungan uranium biasanya dirujuk kepada U
3O
8, yang bermula pada zaman Projek Manhattan apabila U
3O
8digunakan sebagai piawaian pelaporan kimia analitik. [105]
Hubungan fasa dalam sistem uranium-oksigen adalah kompleks. Keadaan pengoksidaan uranium yang paling penting ialah uranium(IV) dan uranium(VI), dan dua oksida yang sepadan ialah uranium dioksida ( UO) .
2) dan uranium trioksida ( UO
3). [106] Uranium oksida lain seperti uranium monoksida (UO), diuranium pentoksida ( U
2O
5), dan uranium peroksida ( UO
4·2H
2O ) juga wujud.
Bentuk uranium oksida yang paling biasa ialah triuranium octoxide ( U
3O
8) dan UO
2. [107] Kedua-dua bentuk oksida adalah pepejal yang mempunyai keterlarutan rendah dalam air dan agak stabil dalam pelbagai keadaan persekitaran. Triuranium oktoksida ialah (bergantung kepada keadaan) sebatian uranium yang paling stabil dan merupakan bentuk yang paling biasa ditemui di alam semula jadi. Uranium dioksida ialah bentuk di mana uranium paling biasa digunakan sebagai bahan api reaktor nuklear. [107] Pada suhu ambien, UO
2secara beransur-ansur akan bertukar kepada U
3O
8. Kerana kestabilannya, uranium oksida secara amnya dianggap sebagai bentuk kimia pilihan untuk penyimpanan atau pelupusan. [107]
Kimia akueus

Garam daripada banyak keadaan pengoksidaan uranium adalah larut dalam air dan boleh dikaji dalam larutan akueus . Bentuk ionik yang paling biasa ialah U3+
(coklat-merah), U4+
(hijau), UO+
2(tidak stabil), dan UO2+
2(kuning), masing-masing untuk U(III), U(IV), U(V) dan U(VI). [108] Beberapa sebatian pepejal dan separa logam seperti UO dan AS wujud untuk keadaan pengoksidaan formal uranium(II), tetapi tiada ion ringkas diketahui wujud dalam larutan untuk keadaan itu. Ion U3+
membebaskan hidrogen daripada air dan oleh itu dianggap sangat tidak stabil. UO _2+
2ion mewakili keadaan uranium(VI) dan diketahui membentuk sebatian seperti uranil karbonat , uranil klorida dan uranil sulfat . UO2+
2juga membentuk kompleks dengan pelbagai agen pengkelat organik , yang paling biasa ditemui ialah uranil asetat . [108]
Tidak seperti garam uranil uranium dan bentuk kationik uranium-oksida ion poliatomik , uranat , garam yang mengandungi anion uranium-oksida poliatomik, umumnya tidak larut dalam air.
Karbonat
Interaksi anion karbonat dengan uranium(VI) menyebabkan rajah Pourbaix banyak berubah apabila medium ditukar daripada air kepada larutan yang mengandungi karbonat. Walaupun sebahagian besar karbonat tidak larut dalam air (pelajar sering diajar bahawa semua karbonat selain daripada logam alkali tidak larut dalam air), uranium karbonat selalunya larut dalam air. Ini kerana kation U(VI) mampu mengikat dua oksida terminal dan tiga atau lebih karbonat untuk membentuk kompleks anionik.
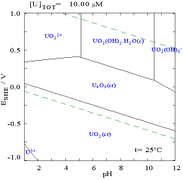 | 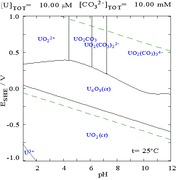 |
| Uranium dalam medium akueus yang tidak kompleks (cth asid perklorik / natrium hidroksida). [109] | Uranium dalam larutan karbonat |
 | 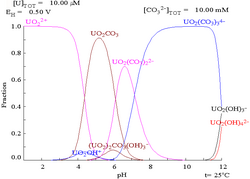 |
| Kepekatan relatif bagi bentuk kimia uranium yang berbeza dalam medium akueus tidak kompleks (cth asid perklorik / natrium hidroksida). [109] | Kepekatan relatif bagi pelbagai bentuk kimia uranium dalam larutan karbonat berair. [109] |
Kesan pH
Gambar rajah pecahan uranium dengan kehadiran karbonat menggambarkan ini dengan lebih lanjut: apabila pH larutan uranium(VI) meningkat, uranium ditukar kepada uranium oksida hidroksida terhidrat dan pada pH tinggi ia menjadi kompleks hidroksida anionik.
Apabila karbonat ditambah, uranium ditukar kepada satu siri kompleks karbonat jika pH meningkat. Satu kesan daripada tindak balas ini ialah peningkatan keterlarutan uranium dalam julat pH 6 hingga 8, fakta yang mempunyai kaitan langsung dengan kestabilan jangka panjang bahan api nuklear uranium dioksida yang dibelanjakan.
Hidrida, karbida dan nitrida
Logam uranium yang dipanaskan hingga 250 hingga 300 °C (482 hingga 572 °F) bertindak balas dengan hidrogen untuk membentuk uranium hidrida . Suhu yang lebih tinggi akan menghilangkan hidrogen secara balik. Sifat ini menjadikan uranium hidrida sebagai bahan permulaan yang mudah untuk menghasilkan serbuk uranium reaktif bersama-sama dengan pelbagai sebatian uranium karbida , nitrida dan halida . [110] Dua pengubahsuaian kristal uranium hidrida wujud: bentuk α yang diperoleh pada suhu rendah dan bentuk β yang dicipta apabila suhu pembentukan melebihi 250 °C. [110]
Uranium karbida dan uranium nitrida adalah kedua-duanya sebatian semilogam lengai yang agak larut dalam asid , bertindak balas dengan air, dan boleh menyala dalam udara untuk membentuk U.
3O
8. [110] Karbida uranium termasuk uranium monokarbid (U C ), uranium dikarbida ( UC
2), dan diuranium tricarbide ( U
2C
3). Kedua-dua UC dan UC
2dibentuk dengan menambahkan karbon kepada uranium cair atau dengan mendedahkan logam kepada karbon monoksida pada suhu tinggi. Stabil di bawah 1800 °C, U
2C
3disediakan dengan menundukkan campuran UC dan UC yang dipanaskan
2kepada tekanan mekanikal. [111] Uranium nitrida yang diperoleh melalui pendedahan langsung logam kepada nitrogen termasuk uranium mononitride (UN), uranium dinitride ( PBB
2), dan diuranium trinitride ( U
2N
3). [111]
Halida

Semua uranium fluorida dicipta menggunakan uranium tetrafluorida ( UF
4); UF
4itu sendiri disediakan oleh hidrofluorinasi uranium dioksida. [110] Pengurangan UF
4dengan hidrogen pada 1000 °C menghasilkan uranium trifluorida ( UF
3). Di bawah keadaan suhu dan tekanan yang betul, tindak balas pepejal UF
4dengan uranium heksafluorida gas ( UF
6) boleh membentuk fluorida perantaraan U
2F
9, U
4F
17, dan UF
5. [110]
Pada suhu bilik, UF
6mempunyai tekanan wap yang tinggi , menjadikannya berguna dalam proses resapan gas untuk memisahkan uranium-235 yang jarang ditemui daripada isotop uranium-238 biasa. Kompaun ini boleh disediakan daripada uranium dioksida dan uranium hidrida melalui proses berikut: [110]
- UO
2+ 4 HF → UF
4+ 2 H
2O (500 °C, endotermik) - UF
4+ F
2→ UF
6(350 °C, endotermik)
UF yang terhasil
6, pepejal putih, sangat reaktif (melalui fluorinasi), mudah menyublim (mengeluarkan wap yang berkelakuan sebagai gas yang hampir ideal ), dan merupakan sebatian uranium yang paling tidak menentu yang diketahui wujud. [110]
Satu kaedah penyediaan uranium tetraklorida ( UCl
4) adalah untuk menggabungkan secara langsung klorin dengan logam uranium atau uranium hidrida. Pengurangan UCl
4oleh hidrogen menghasilkan uranium triklorida ( UCl
3) manakala klorida uranium yang lebih tinggi disediakan melalui tindak balas dengan klorin tambahan. [110] Semua uranium klorida bertindak balas dengan air dan udara.
Bromida dan iodida uranium terbentuk melalui tindak balas langsung, masing-masing, bromin dan iodin dengan uranium atau dengan menambahkan UH
3kepada asid unsur tersebut. [110] Contoh yang diketahui termasuk: UBr
3, UBr
4, UI
3, dan UI
4. UI
5tidak pernah disediakan. Uranium oxyhalida adalah larut air dan termasuk UO
2F
2, UOCl
2, UO
2Cl
2, dan UO
2Br
2. Kestabilan oksihalida berkurangan apabila berat atom komponen halida bertambah. [110]
Isotop
Uranium, seperti semua unsur dengan nombor atom lebih daripada 82, tidak mempunyai isotop yang stabil . Semua isotop uranium adalah radioaktif kerana daya nuklear yang kuat tidak mengatasi tolakan elektromagnet dalam nuklida yang mengandungi lebih daripada 82 proton. [112] Namun begitu, dua isotop yang paling stabil, uranium-238 dan uranium-235, mempunyai separuh hayat yang cukup lama untuk berlaku di alam semula jadi sebagai radionuklid primordial , dengan kuantiti yang boleh diukur telah bertahan sejak pembentukan Bumi. [113] Kedua-dua nuklida ini , bersama-sama dengan torium-232, adalah satu-satunya nuklida primordial yang disahkan lebih berat daripada bismut-209 yang hampir stabil . [4] [114]
Uranium semulajadi terdiri daripada tiga isotop utama: uranium-238 (99.28% kelimpahan semula jadi), uranium-235 (0.71%), dan uranium-234 (0.0054%). Terdapat juga empat isotop surih lain: uranium-239, yang terbentuk apabila 238 U mengalami pembelahan spontan, melepaskan neutron yang ditangkap oleh atom 238 U yang lain; uranium-237, yang terbentuk apabila 238 U menangkap neutron tetapi memancarkan dua lagi, yang kemudiannya mereput kepada neptunium-237 ; uranium-236 , yang berlaku dalam kuantiti surih akibat penangkapan neutron pada 235 U dan sebagai hasil pereputan plutonium-244 ; [114] dan akhirnya, uranium-233 , yang terbentuk dalamrantaian pereputan neptunium-237.
Uranium-238 ialah isotop uranium yang paling stabil, dengan separuh hayat kira-kira4.463 × 10 9 tahun, [4] kira-kira umur Bumi . Uranium-238 kebanyakannya merupakan pemancar alfa, mereput kepada torium-234. Ia akhirnya mereput melalui siri uranium , yang mempunyai 18 ahli, menjadi plumbum-206 . [15] Uranium-238 bukan fisil, tetapi merupakan isotop yang subur, kerana selepas pengaktifan neutron ia boleh ditukar kepada plutonium-239, isotop fisil lain. Sesungguhnya, nukleus 238 U boleh menyerap satu neutron untuk menghasilkan isotop radioaktif uranium-239 . 239 U mereput melalui pelepasan beta kepada neptunium-239, juga pemancar beta, yang mereput pada gilirannya, dalam beberapa hari menjadi plutonium-239. 239 Pu telah digunakan sebagai bahan fisil dalam bom atom pertama yang diletupkan dalam "ujian Trinity" pada 15 Julai 1945 di New Mexico . [40]
Uranium-235 mempunyai separuh hayat kira-kira7.04 × 10 8 tahun; ia adalah isotop uranium paling stabil seterusnya selepas 238 U dan juga kebanyakannya pemancar alfa, mereput kepada torium-231. [4] Uranium-235 adalah penting untuk kedua-dua reaktor nuklear dan senjata nuklear , kerana ia adalah satu-satunya isotop uranium yang wujud di alam semula jadi di Bumi dalam apa-apa jumlah ketara yang boleh dibelah. Ini bermakna ia boleh dipecahkan kepada dua atau tiga serpihan ( hasil pembelahan ) oleh neutron haba. [15] Rantai pereputan 235 U, yang dipanggil siri aktinium , mempunyai 15 ahli dan akhirnya mereput menjadi plumbum-207. [15]Kadar pereputan yang berterusan dalam siri pereputan ini menjadikan perbandingan nisbah induk kepada unsur anak berguna dalam pentarikhan radiometrik.
Uranium-236 mempunyai separuh hayat2.342 × 10 7 tahun [4] dan tidak ditemui dalam kuantiti yang ketara dalam alam semula jadi. Separuh hayat uranium-236 adalah terlalu pendek untuk menjadi primordial, walaupun ia telah dikenal pasti sebagai nenek moyang pupus anak perempuan pereputan alfanya, thorium-232. [67] Uranium-236 berlaku dalam bahan api nuklear terpakai apabila penangkapan neutron pada 235 U tidak mendorong pembelahan, atau sebagai hasil pereputan plutonium-240 . Uranium-236 tidak subur, kerana tiga lagi penangkapan neutron diperlukan untuk menghasilkan fisil 239 Pu, dan bukan fisil itu sendiri; oleh itu, ia dianggap sisa radioaktif tahan lama. [117]
Uranium-234 ialah ahli siri uranium dan berlaku dalam keseimbangan dengan progenitornya, 238 U; ia mengalami pereputan alfa dengan separuh hayat 245,500 tahun [4] dan mereput kepada plumbum-206 melalui satu siri isotop jangka pendek.
Uranium-233 mengalami pereputan alfa dengan separuh hayat 160,000 tahun dan, seperti 235 U, adalah fisil. [10] Ia boleh dibiakkan daripada torium-232 melalui pengeboman neutron, biasanya dalam reaktor nuklear; proses ini dikenali sebagai kitaran bahan api torium . Disebabkan oleh fissility 233 U dan lebihan semula jadi torium (tiga kali ganda uranium), [118] 233 U telah disiasat untuk digunakan sebagai bahan api nuklear sebagai alternatif yang mungkin kepada 235 U dan 239 Pu, [119] walaupun tidak digunakan secara meluas setakat 2022 . [118] Rantaian pereputan uranium-233 membentuk sebahagian daripadasiri neptunium dan berakhir pada bismut-209 yang hampir stabil (separuh hayat2.01 × 10 19 tahun ) [4] dan talium stabil -205.
Uranium-232 adalah pemancar alfa dengan separuh hayat 68.9 tahun. [4] Isotop ini dihasilkan sebagai hasil sampingan dalam pengeluaran 233 U dan dianggap sebagai kacau ganggu, kerana ia tidak boleh fisil dan mereput melalui pemancar alfa dan gamma jangka pendek seperti 208 Tl . [119] Ia juga dijangka bahawa torium-232 sepatutnya boleh mengalami pereputan beta berganda , yang akan menghasilkan uranium-232, tetapi ini belum lagi diperhatikan secara eksperimen. [4]
Semua isotop dari 232 U hingga 236 U termasuk mempunyai cabang pereputan kelompok kecil (kurang daripada10 −10 %), dan semua bar ini 233 U, sebagai tambahan kepada 238 U, mempunyai cawangan pembelahan spontan kecil ; [4] nisbah cawangan terbesar untuk pembelahan spontan adalah kira-kira5 × 10 −5 % untuk 238 U, atau kira-kira satu dalam setiap dua juta pereputan. [120] Isotop surih yang berumur lebih pendek 237 U dan 239 U secara eksklusif mengalami pereputan beta , dengan separuh hayat masing-masing 6.752 hari dan 23.45 minit. [4]
Secara keseluruhannya, 28 isotop uranium telah dikenal pasti, dalam julat nombor jisim dari 214 [121] hingga 242, kecuali 220. [4] [122] Antara isotop uranium yang tidak ditemui dalam sampel semula jadi atau bahan api nuklear, yang paling lama -hidup ialah 230 U, pemancar alfa dengan separuh hayat 20.23 hari. [4] Isotop ini telah dipertimbangkan untuk digunakan dalam terapi zarah alfa (TAT) yang disasarkan. [123] Semua isotop lain mempunyai separuh hayat lebih pendek daripada satu jam, kecuali 231 U (separuh hayat 4.2 hari) dan 240 U (separuh hayat 14.1 jam). [4] Isotop terpendek yang diketahui ialah 221U, dengan separuh hayat 660 nanosaat, dan dijangkakan bahawa 220 U yang tidak diketahui sehingga kini mempunyai separuh hayat yang lebih pendek. [124] Isotop kaya proton yang lebih ringan daripada 232 U terutamanya mengalami pereputan alfa, kecuali 229 U dan 231 U, yang masing-masing mereput kepada isotop protaktinium melalui pelepasan positron dan penangkapan elektron ; 240 U dan 242 U yang kaya dengan neutron mengalami pereputan beta untuk membentuk isotop neptunium . [4]
Pengayaan

Secara semula jadi, uranium didapati sebagai uranium-238 (99.2742%) dan uranium-235 (0.7204%). Pengasingan isotop menumpukan (memperkaya) uranium-235 fisil untuk senjata nuklear dan kebanyakan loji kuasa nuklear, kecuali untuk reaktor yang disejukkan gas dan reaktor air berat bertekanan . Kebanyakan neutron yang dikeluarkan oleh atom pembelahan uranium-235 mesti memberi kesan kepada atom uranium-235 yang lain untuk mengekalkan tindak balas rantai nuklear . Kepekatan dan jumlah uranium-235 yang diperlukan untuk mencapai ini dipanggil ' jisim kritikal '.
Untuk dianggap 'diperkaya', pecahan uranium-235 hendaklah antara 3% dan 5%. [125] Proses ini menghasilkan kuantiti uranium yang banyak yang habis uranium-235 dan dengan peningkatan yang sepadan dengan pecahan uranium-238, dipanggil uranium habis atau 'DU'. Untuk dianggap 'habis', kepekatan isotop uranium-235 hendaklah tidak lebih daripada 0.3%. [126] Harga uranium telah meningkat sejak 2001, jadi tailing pengayaan yang mengandungi lebih daripada 0.35% uranium-235 sedang dipertimbangkan untuk pengayaan semula, mendorong harga uranium heksafluorida yang habis melebihi $130 sekilogram pada Julai 2007 daripada $5 pada tahun 2001. [126]
Proses emparan gas , di mana uranium heksafluorida gas ( UF
6) dipisahkan oleh perbezaan berat molekul antara 235 UF 6 dan 238 UF 6 menggunakan emparan berkelajuan tinggi , merupakan proses pengayaan yang paling murah dan terkemuka. [37] Proses resapan gas telah menjadi kaedah utama untuk pengayaan dan digunakan dalam Projek Manhattan . Dalam proses ini, uranium heksafluorida berulang kali disebarkan melalui membran perak - zink , dan isotop uranium yang berbeza dipisahkan oleh kadar resapan (kerana uranium-238 lebih berat ia meresap lebih perlahan daripada uranium-235). [37] Yangkaedah pemisahan isotop laser molekul menggunakan pancaran laser tenaga yang tepat untuk memutuskan ikatan antara uranium-235 dan fluorin. Ini meninggalkan uranium-238 terikat kepada fluorin dan membolehkan logam uranium-235 memendakan daripada larutan. [7] Kaedah pengayaan laser alternatif dikenali sebagai pemisahan isotop laser wap atom (AVLIS) dan menggunakan laser boleh tala yang boleh dilihat seperti laser pewarna . [127] Kaedah lain yang digunakan ialah resapan haba cecair. [9]
Satu-satunya sisihan ketara daripada nisbah 235 U hingga 238 U dalam mana-mana sampel semula jadi yang diketahui berlaku di Oklo , Gabon , di mana reaktor pembelahan nuklear semulajadi menggunakan sebahagian daripada 235 U kira-kira dua bilion tahun lalu apabila nisbah 235 U kepada 238 U adalah lebih serupa dengan uranium yang diperkaya rendah yang membenarkan air biasa ("ringan") bertindak sebagai penyederhana neutron serupa dengan proses dalam reaktor air ringan buatan manusia . Kewujudan reaktor pembelahan semula jadi sedemikian yang telah diramalkan secara teori sebelum ini telah terbukti sebagai sisihan sedikit sebanyak 235Kepekatan U daripada nilai jangkaan ditemui semasa pengayaan uranium di Perancis. Siasatan seterusnya untuk menolak sebarang tindakan manusia yang jahat (seperti mencuri 235 U) mengesahkan teori itu dengan mencari nisbah isotop produk pembelahan biasa (atau lebih tepatnya nuklida anak perempuannya yang stabil) selaras dengan nilai yang dijangkakan untuk pembelahan tetapi menyimpang daripada nilai yang dijangkakan. untuk sampel terbitan bukan pembelahan bagi unsur-unsur tersebut.
Pendedahan manusia
Seseorang boleh terdedah kepada uranium (atau anak perempuan radioaktifnya , seperti radon ) dengan menyedut habuk di udara atau dengan menelan air dan makanan yang tercemar. Jumlah uranium dalam udara biasanya sangat kecil; walau bagaimanapun, orang yang bekerja di kilang yang memproses baja fosfat , tinggal berhampiran kemudahan kerajaan yang membuat atau menguji senjata nuklear, tinggal atau bekerja berhampiran medan perang moden di mana senjata uranium yang telah habis digunakan, [8] atau tinggal atau bekerja berhampiran arang batu . loji kuasa, kemudahan yang melombong atau memproses bijih uranium, atau memperkayakan uranium untuk bahan api reaktor, mungkin telah meningkatkan pendedahan kepada uranium. [128] [129]Rumah atau struktur yang mempunyai lebihan deposit uranium (sama ada deposit sanga asli atau buatan manusia) mungkin mempunyai peningkatan insiden pendedahan kepada gas radon. Pentadbiran Keselamatan dan Kesihatan Pekerjaan (OSHA) telah menetapkan had pendedahan yang dibenarkan untuk pendedahan uranium di tempat kerja sebagai 0.25 mg/m 3 sepanjang 8 jam hari bekerja. Institut Keselamatan dan Kesihatan Pekerjaan Kebangsaan (NIOSH) telah menetapkan had pendedahan yang disyorkan (REL) sebanyak 0.2 mg/m 3 sepanjang 8 jam hari bekerja dan had jangka pendek 0.6 mg/m 3 . Pada tahap 10 mg/m 3 , uranium segera berbahaya kepada kehidupan dan kesihatan . [130]
Kebanyakan uranium yang tertelan dikumuhkan semasa penghadaman . Hanya 0.5% diserap apabila bentuk uranium yang tidak larut, seperti oksidanya, ditelan, manakala penyerapan ion uranil yang lebih larut boleh sehingga 5%. [31] Walau bagaimanapun, sebatian uranium larut cenderung untuk melepasi badan dengan cepat, manakala sebatian uranium tidak larut, terutamanya apabila disedut melalui habuk ke dalam paru-paru , menimbulkan bahaya pendedahan yang lebih serius. Selepas memasuki aliran darah, uranium yang diserap cenderung untuk bioakumulasi dan kekal selama bertahun-tahun dalam tisu tulang kerana pertalian uranium dengan fosfat. [31] Uranium yang digabungkan menjadi uranilion, yang terkumpul dalam tulang, hati, buah pinggang, dan tisu pembiakan. [131]
Ketoksikan radiologi dan kimia uranium digabungkan dengan fakta bahawa unsur-unsur nombor atom Z tinggi seperti uranium mempamerkan hantu atau radiotoksisiti sekunder walaupun penyerapan gamma latar belakang semula jadi dan sinar-X dan pancaran semula fotoelektron, yang digabungkan dengan pertalian tinggi uranium. kepada bahagian fosfat DNA menyebabkan peningkatan bilangan pecahan DNA untai tunggal dan berganda. [132]
Uranium tidak diserap melalui kulit, dan zarah alfa yang dikeluarkan oleh uranium tidak dapat menembusi kulit. [28]
Uranium boleh dinyahcemarkan daripada permukaan keluli [133] dan akuifer . [134] [135]
Kesan dan langkah berjaga-jaga
Fungsi normal buah pinggang , otak , hati , jantung , dan sistem lain boleh terjejas oleh pendedahan uranium, kerana, selain bersifat radioaktif yang lemah, uranium ialah logam toksik . [31] [136] [137] Uranium juga merupakan bahan toksik pembiakan . [138] [139] Kesan radiologi biasanya tempatan kerana sinaran alfa, bentuk utama pereputan 238 U, mempunyai julat yang sangat pendek, dan tidak akan menembusi kulit. Sinaran alfa daripada uranium yang disedut telah dibuktikan menyebabkan kanser paru-paru pada pekerja nuklear yang terdedah. [140]Walaupun CDC telah menerbitkan satu kajian bahawa tiada kanser manusia telah dilihat sebagai akibat daripada pendedahan kepada uranium semula jadi atau habis, [141] pendedahan kepada uranium dan produk pereputannya, terutamanya radon , adalah ancaman kesihatan yang ketara. [142] Pendedahan kepada strontium-90 , iodin-131 , dan produk pembelahan lain tidak berkaitan dengan pendedahan uranium, tetapi mungkin disebabkan oleh prosedur perubatan atau pendedahan kepada bahan api reaktor terpakai atau kejatuhan daripada senjata nuklear. [143]
Walaupun pendedahan penyedutan secara tidak sengaja kepada kepekatan tinggi uranium heksafluorida telah mengakibatkan kematian manusia, kematian tersebut dikaitkan dengan penjanaan asid hidrofluorik dan uranil fluorida yang sangat toksik dan bukannya dengan uranium itu sendiri. [144] Logam uranium yang dibahagikan halus menimbulkan bahaya kebakaran kerana uranium adalah piroforik ; butiran kecil akan menyala secara spontan di udara pada suhu bilik. [10]
Logam uranium biasanya dikendalikan dengan sarung tangan sebagai langkah berjaga-jaga yang mencukupi. [145] Pekat uranium dikendalikan dan dibendung untuk memastikan orang tidak menyedut atau menelannya. [145]
Lihat juga
- Sisa K-65
- Senarai negara mengikut pengeluaran uranium
- Senarai negara mengikut rizab uranium
- Senarai projek uranium
- Senarai bencana nuklear dan insiden radioaktif
- Kemalangan dan insiden nuklear dan sinaran
- Kejuruteraan nuklear
- Kitaran bahan api nuklear
- Fizik nuklear
- Ikatan kuintupel (sebelum ini dianggap sebagai ikatan Phi ), dalam molekul U 2
- Kitaran bahan api Thorium
- Pendengaran Uranium Dunia
Nota
- ^ "Berat Atom Piawai: Uranium" . CIAAW . 1999.
- ^ Th(-I) dan U(-I) telah dikesan dalam fasa gas sebagai anion oktakarbonil; lihat Chaoxian, Chi; Sudip, Kuali; Jiaye, Jin; Luyan, Meng; Mingbiao, Luo; Lili, Zhao; Mingfei, Zhou; Gernot, Frenking (2019). "Kompleks Ion Oktakarbonil Aktinida [An(CO) 8 ] +/− (An=Th, U) dan Peranan f Orbital dalam Ikatan Logam–Ligan" . Kimia (Weinheim an der Bergstrasse, Jerman). 25 (50): 11772–11784 . 25 (50): 11772–11784. doi : 10.1002/chem.201902625 . ISSN 0947-6539 . PMC 6772027 . PMID 31276242 .
- ^ Morss, LR; Edelstein, NM; Fuger, J., eds. (2006). The Chemistry of the Actinide and Transactinide Elements (edisi ke-3). Belanda: Springer. ISBN 978-9048131464.
- ^a b c d e f g h i j k l m n o Kondev, FG; Wang, M.; Huang, WJ; Naimi, S.; Audi, G. (2021). "Penilaian NUBASE2020 sifat nuklear"(PDF). Fizik Cina C. 45(3): 030001.doi:10.1088/1674-1137/abddae.
- ^ Magurno, BA; Pearlstein, S, eds. (1981). Prosiding persidangan mengenai kaedah dan prosedur penilaian data nuklear. BNL-NCS 51363, jld. II (PDF) . Upton, NY (AS): Brookhaven National Lab. hlm 835 dsb . Dicapai pada 6 Ogos 2014 .
- ^ "Uranium" . Ensiklopedia Britannica . Dicapai pada 22 April 2017 .
- ^a b c d e Emsley 2001, hlm. 479.
- ^a b c Fink, Margit (2005-08-11)"Metal of Dishonor" – peluru dari Uranium (DU) yang habis mencemari tanah di kawasan krisis. Bundesforschungsanstalt für Landwirtschaft
- ^a b c d e f "Uranium" . Ensiklopedia Sains dan Teknologi McGraw-Hill(edisi ke-5). The McGraw-Hill Companies, Inc. 2005.ISBN 978-0-07-142957-3.
- ^a b c d e f g h i j k l m n o p q Hammond, CR (2000). The Elements, dalam Buku Panduan Kimia dan Fizik (PDF)(edisi ke-81). akhbar CRC. ISBN 978-0-8493-0481-1.
- ^ "Uranium" . Persatuan Kimia Diraja.
- ^ "Lead" . Persatuan Kimia Diraja.
- ^ "Tungsten" . Persatuan Kimia Diraja.
- ^ "Emas" . Persatuan Kimia Diraja.
- ^a b c d e f g "uranium". Columbia Electronic Encyclopedia(edisi ke-6). Columbia University Press. Diarkibkan daripadayang asalpada 27 Julai 2011. Dicapai pada 27 September 2008.
- ^a b c d e "uranium". Ensiklopedia Pengintipan, Perisikan dan Keselamatan. The Gale Group, Inc. Diarkibkan daripadayang asalpada 27 Julai 2011. Dicapai pada 27 September 2008.
- ^ Rolllett, AD (2008). Aplikasi Analisis Tekstur . John Wiley dan Sons. hlm. 108. ISBN 978-0-470-40835-3.
- ^a b c Grenthe, Ingmar; Drożdżyński, Janusz; Fujino, Takeo; Buck, Edgar C.; Albrecht-Schmitt, Thomas E.; Wolf, Stephen F. (2006). "Uranium". Dalam Morss, Lester R.; Edelstein, Norman M.; Fuger, Jean (eds.). Kimia Unsur Aktinida dan Transaktinida (PDF). Vol. 5 (edisi ke-3). Dordrecht, Belanda: Springer. ms 52–160. doi:10.1007/1-4020-3598-5_5. ISBN 978-1-4020-3555-5. Diarkibkan daripada yang asal (PDF) pada 7 Mac 2016.
- ^ "Pembangunan DU Munitions" . Uranium yang berkurangan di Teluk (II) . Gulflink, laman web rasmi Force Health Protection & Readiness. 2000.
- ^ Schnug, E. and Haneklaus, S. (2008) Uran – Umwelt – Unbehagen . Institut für Pflanzenernährung und Bodenkunde
- ^ Fink, M. (2004) Uran – Umwelt – Unbehagen . Bundesforschungsanstalt für Landwirtschaft
- ^ Jenama RA, Schnug E (2005). "Uranium Habis: Pencemar Radiotoksologi Persekitaran Baharu" . FAL – Agric. Res . 55 (4): 211–218.
- ^a b c d e Emsley 2001, hlm. 480.
- ^ "Reka Bentuk Senjata Nuklear" . Persekutuan Saintis Amerika. 1998. Diarkibkan daripada yang asal pada 26 Disember 2008 . Dicapai pada 19 Februari 2007 .
- ^ "Kenyataan mengenai siaran Good Morning America ," The Homer Laughlin China Co. Diarkibkan pada 1 April 2012 di Wayback Machine , 16 Mac 2011, diakses pada 25 Mac 2012.
- ^ "Dail R untuk radioaktif – 12 Julai 1997 – Saintis Baru" . Newscientist.com . Dicapai pada 12 September 2008 .
- ^ "Perlombongan Uranium" . Yayasan Warisan Atom . Yayasan Warisan Atom . Dicapai pada 23 Disember 2020 .
- ^a b "Fakta EPA tentang Uranium"(PDF). Agensi Perlindungan Alam Sekitar AS. Dicapai pada 20 September 2014.
- ^ "Uranium Mengandungi Gigi Palsu (sekitar 1960-an, 1970-an)" . Muzium Sinaran dan Radioaktiviti ORAU . Universiti Bersekutu Oak Ridge . 1999 . Dicapai pada 11 Oktober 2021 .
- ^ Emsley 2001 , hlm. 482.
- ^a b c d e f g h i j Emsley 2001, hlm. 477.
- ^ Velek, Victor (7 Mei 2008). "Uran tersandung di bandar-bandar merayu" . Pos Prague . Dicapai pada 7 Julai 2022 .
- ^ "Sejarah Perlombongan Bijih & Uranium di Czechia" . November 2017.
- ^ Klaproth, MH (1789). "Chemische Untersuchung des Uranits, einer neuentdeckten metallischen Substanz". Kimia Annalen . 2 : 387–403.
- ^ "Uranium" . Kamus Warisan Amerika Bahasa Inggeris (edisi ke-4). Syarikat Houghton Mifflin. Diarkibkan daripada yang asal pada 27 Julai 2011 . Dicapai pada 15 Januari 2007 .
- ^ Péligot, E.-M. (1842). "Recherches Sur L'Uranium" . Annales de chimie et de physique . 5 (5): 5–47.
- ^a b c d Emsley 2001, hlm. 478.
- ^ "The Electric Journal" . Kelab Westinghouse. 10 April 1920 – melalui Buku Google.
- ^ Gillett, Horace Wadsworth; Mack, Edward Lawrence (10 April 1917). Penyediaan ferro-uranium . Kertas Teknikal 177 – Biro Perlombongan AS. Kerajaan AS cetak. dimatikan. – melalui Buku Google.
- ^a b c d e f Seaborg 1968, hlm. 773.
- ^ Fermi, Enrico (12 Disember 1938). "Radioaktiviti buatan yang dihasilkan oleh pengeboman neutron: Kuliah Nobel" (PDF) . Akademi Sains Diraja Sweden. Diarkibkan daripada yang asal (PDF) pada 9 Ogos 2018 . Dicapai pada 14 Jun 2017 .
- ^ De Gregorio, A. (2003). "Nota Sejarah Mengenai Bagaimana Harta Ditemui bahawa Bahan Terhidrogenasi Meningkatkan Keradioaktifan yang Dicetuskan oleh Neutron". Nuovo Saggiatore . 19 : 41–47. arXiv : fizik/0309046 . Bibcode : 2003fizik...9046D .
- ^ Nigro, M. (2004). "Hahn, Meitner e la teoria della fissione" (PDF) . Diarkibkan daripada yang asal (PDF) pada 25 Mac 2009 . Dicapai pada 5 Mei 2009 .
- ^ van der Krogt, Peter. "Elementymology & Elements Multidict" . Dicapai pada 5 Mei 2009 .
- ^ Meitner, L. ; Frisch, O. (1939). "Pecahan Uranium oleh Neutron: Jenis Tindak Balas Nuklear Baru" . alam semula jadi . 143 (5218): 239–240. Bibcode : 1969Natur.224..466M . doi : 10.1038/224466a0 . S2CID 4188874 .
- ^ "Alfred OC Nier" . www.aps.org . Dicapai pada 4 Disember 2016 .
- ^ Manfred Popp (21 September 2016). "Wissenschaftsgeschichte: Hitlers Atombombe – warum es sie nicht gab – Spektrum der Wissenschaft" . Spektrum.de . Dicapai pada 25 Februari 2022 .
- ^ "Chicago Pile One" . besar.stanford.edu . Dicapai pada 4 Disember 2016 .
- ^ Walsh, John (19 Jun 1981). "A Manhattan Project Postscript" (PDF) . Sains . AAAS. 212 (4501): 1369–1371. Bibcode : 1981Sci...212.1369W . doi : 10.1126/sains.212.4501.1369 . PMID 17746246 . Dicapai pada 23 Mac 2013 .
- ^ Helmreich, JE Gathering Rare Ores: The Diplomacy of Uranium Acquisition, 1943–1954 , Princeton UP, 1986: ch. 10 ISBN 0-7837-9349-9
- ^ Schnug, Ewald (2014). "Ke mana hilangnya semua uranium? Atau apa yang memberi makan kepada Dimona - bukti mengikut keadaan untuk nasib haram uranium daripada pemprosesan fosfat batu". Uranium – Cabaran Masa Lalu dan Masa Depan . Springer. ms 731–738. doi : 10.1007/978-3-319-11059-2_84 . ISBN 978-3-319-11058-5.
- ^ "Reaktor Direka oleh Argonne National Laboratory: Fast Reactor Technology" . Jabatan Tenaga AS, Makmal Kebangsaan Argonne. 2012 . Dicapai pada 25 Julai 2012 .
- ^ "Sejarah dan Kejayaan Makmal Kebangsaan Argonne: Bahagian 1" . Jabatan Tenaga AS, Makmal Kebangsaan Argonne. 1998. Diarkibkan daripada yang asal pada 26 September 2006 . Dicapai pada 28 Januari 2007 .
- ^ "Reaktor Direka oleh Makmal Kebangsaan Argonne: Pembangunan Teknologi Reaktor Air Ringan" . Jabatan Tenaga AS, Makmal Kebangsaan Argonne. 2012 . Dicapai pada 25 Julai 2012 .
- ^ "1956: Queen menghidupkan kuasa nuklear" . Berita BBC . 17 Oktober 1956 . Dicapai pada 28 Jun 2006 .
- ^ "STR (Reaktor Terma Kapal Selam) dalam "Reactors Designed by Argonne National Laboratory: Light Water Reactor Technology Development"" . Jabatan Tenaga AS, Makmal Kebangsaan Argonne. 2012 . Diperoleh pada 25 Julai 2012 .
- ^a b "Oklo: Reaktor Nuklear Semula Jadi". Pejabat Pengurusan Sisa Radioaktif Awam. Diarkibkan daripadayang asalpada 3 Jun 2004. Dicapai pada 28 Jun 2006.
- ^ Warneke, T.; Croudace, IW; Warwick, PE & Taylor, RN (2002). "Rekod kejatuhan aras tanah baharu bagi isotop uranium dan plutonium untuk latitud sederhana utara". Surat Sains Bumi dan Planet . 203 (3–4): 1047–1057. Kod Bib : 2002E&PSL.203.1047W . doi : 10.1016/S0012-821X(02)00930-5 .
- ^ "Bencana Nuklear Terburuk" . Time.com. 25 Mac 2009. Diarkibkan daripada yang asal pada 28 Mac 2009 . Dicapai pada 24 Mei 2010 .
- ^ Gilliland, Frank D.; Hunt, William C.; Pardilla, Marla; Key, Charles R. (Mac 2000). "Perlombongan Uranium dan Kanser Paru-paru Di Kalangan Lelaki Navajo di New Mexico dan Arizona, 1969 hingga 1993". Jurnal Perubatan Pekerjaan dan Alam Sekitar . 42 (3): 278–283. doi : 10.1097/00043764-200003000-00008 . PMID 10738707 .
- ^ Brugge, Doug; Goble, Rob (2002). "Sejarah Perlombongan Uranium dan Orang Navajo" . Jurnal Kesihatan Awam Amerika . Ajph.org. 92 (9): 1410–1419. doi : 10.2105/AJPH.92.9.1410 . PMC 3222290 . PMID 12197966 .
- ^ Van Unnik, JG; Broerse, JJ; Geleijns, J.; Jansen, JT; Zoetelief, J.; Zweers, D. (1997). "Tinjauan teknik CT dan dos yang diserap di pelbagai hospital Belanda". Jurnal Radiologi British . 70 (832): 367–371. doi : 10.1259/bjr.70.832.9166072 . PMID 9166072 . (3000 peperiksaan dari 18 hospital)
- ^ Kitaran Bahan Api Nuklear Rusia . Persatuan Nuklear Dunia. Dikemas kini Disember 2021.
- ^ "Sejarah/Asal Bahan Kimia" . NASA . Dicapai pada 1 Januari 2013 .
- ^ Burbidge, EM; Burbidge, GR; Fowler, WA; Hoyle, F. (1957). "Sintesis Unsur dalam Bintang" . Kajian Fizik Moden . 29 (4): 547. Bibcode : 1957RvMP...29..547B . doi : 10.1103/RevModPhys.29.547 .
- ^ Clayton, Donald D. (1968). Prinsip Evolusi Stellar dan Nukleosintesis . New York: Mc-Graw-Hill. ms 577–91. ISBN 978-0226109534.
- ^a b Trenn, Thaddeus J. (1978). "Thoruranium (U-236) sebagai induk semula jadi torium yang pupus: Pemalsuan pramatang teori yang pada asasnya betul". Riwayat Sains. 35(6): 581–97. doi:10.1080/00033797800200441.
- ^ Tissot, François LH; Dauphas, Nicolas; Grossmann, Lawrence (4 Mac 2016). "Asal usul variasi isotop uranium dalam kondensat nebula suria awal" . Kemajuan Sains . 2 (3): e1501400. arXiv : 1603.01780 . Bibcode : 2016SciA....2E1400T . doi : 10.1126/sciadv.1501400 . PMC 4783122 . PMID 26973874 .
- ^ Biever, Celeste (27 Julai 2005). "Pengukuran pertama keradioaktifan teras Bumi" . Saintis Baru . Dicapai pada 7 Julai 2022 .
- ^ "Potassium-40 memanaskan teras Bumi" . physicsworld.com . 7 Mei 2003 . Dicapai pada 14 Januari 2007 .
- ^ Schnug, E., Sun, Y., Zhang, L., Windmann, H., Lottermoser, BG, Ulrich, AE, Bol, R., Makeawa, M., dan Haneklaus, SH (2023) "Muat unsur dengan baja fosfat – kekangan untuk produktiviti tanah?" In: Bolan, NS and Kirkham, MB (eds.) Mengurus Kekangan Tanah untuk Mengekalkan Produktiviti . Akhbar CRC.
- ^ Min, M.; Xu, H.; Chen, J.; Fayek, M. (2005). "Bukti biomineralisasi uranium dalam deposit uranium roll-front yang dihoskan batu pasir, barat laut China". Kajian Bijih Geologi . 26 (3–4): 198. doi : 10.1016/j.oregeorev.2004.10.003 .
- ^ Koribanics, NM; Tuorto, SJ; Lopez-Chiaffarelli, N.; McGuinness, LR; Häggblom, MM; Williams, KH; Panjang, PE; Kerkhof, LJ (2015). "Taburan Ruang bagi Betaproteobacterium Bernafas Uranium di Tapak Penyelidikan Lapangan CO Rifle" . PLOS ONE . 10 (4): e0123378. Bibcode : 2015PLoSO..1023378K . doi : 10.1371/journal.pone.0123378 . PMC 4395306 . PMID 25874721 .
- ^ Renshaw, JC; Butchins, LJC; Livens, FR; et al. (Jun 2005). "Bioreduksi uranium: implikasi alam sekitar perantaraan pentavalen". Sains & Teknologi Alam Sekitar . 39 (15): 5657–5660. Bibcode : 2005EnST...39.5657R . doi : 10.1021/es048232b . PMID 16124300 .
- ^ Vitesse, GF; Morris, K; Natrajan, LS; Shaw, S (Januari 2020). "Barisan Pelbagai Bukti Mengenalpasti U(V) sebagai Perantara Utama semasa Pengurangan U(VI) oleh Shewanella oneidensis MR1" . Sains & Teknologi Alam Sekitar . 54 (4): 2268–2276. Kod bib : 2020EnST...54.2268V . doi : 10.1021/acs.est.9b05285 . PMID 31934763 .
- ^ Emsley 2001 , hlm. 476 dan 482.
- ^ Macaskie, LE; Empson, RM; Cheetham, AK; Grey, CP & Skarnulis, AJ (1992). "Bioakumulasi uranium oleh Citrobacter sp. hasil daripada pertumbuhan pengantaraan enzim HUO polihabluran
2PO
4". Sains . 257 (5071): 782–784. Bibcode : 1992Sci...257..782M . doi : 10.1126/science.1496397 . PMID 1496397 . - ^ Anderson, RT; Vrionis, HA; Ortiz-Bernad, I.; Resch, CT; Panjang, PE; Dayvault, R.; Karp, K.; Marutzky, S.; Metzler, DR; Peacock, A.; Putih, DC; Lowe, M.; Lovley, DR (2003). "Merangsang aktiviti in situ spesies Geobacter untuk mengeluarkan uranium daripada air bawah tanah akuifer yang tercemar uranium" . Mikrobiologi Gunaan dan Persekitaran . 69 (10): 5884–5891. Bibcode : 2003ApEnM..69.5884A . doi : 10.1128/AEM.69.10.5884-5891.2003 . PMC 201226 . PMID 14532040 .
- ^ Gadd, GM (Mac 2010). "Logam, mineral dan mikrob: geomikrobiologi dan bioremediasi" . Mikrobiologi . 156 (Pt 3): 609–643. doi : 10.1099/mic.0.037143-0 . PMID 20019082 .
- ^ Nilgiriwala, KS; Alahari, A.; Rao, AS & Apte, SK (2008). "Pengklonan dan Ekspresi Beralkali Phosphatase PhoK daripada Sphingomonas sp. Terikan BSAR-1 untuk Biopemendakan Uranium daripada Larutan Beralkali" . Mikrobiologi Gunaan dan Persekitaran . 74 (17): 5516–5523. Bibcode : 2008ApEnM..74.5516N . doi : 10.1128/AEM.00107-08 . PMC 2546639 . PMID 18641147 .
- ^a b c d "Perlombongan Uranium Dunia". Persatuan Nuklear Dunia. Dicapai pada 31 Januari 2023.
- ^ Seaborg 1968 , hlm. 774.
- ^ "Lembangan Athabasca, Saskatchewan" . Dicapai pada 4 September 2009 .
- ^ Gupta, CK & Mukherjee, TK (1990). Hidrometalurgi dalam proses pengekstrakan . Vol. 1. CRC Press. ms 74–75. ISBN 978-0-8493-6804-2.
- ^ "Pengeluaran uranium" . Dunia Kita dalam Data . Dicapai pada 6 Mac 2020 .
- ^a b "Bekalan Uranium: Bekalan Uranium – Persatuan Nuklear Dunia". www.world-nuclear.org.
- ^a b "Sumber Uranium Global untuk Memenuhi Unjuran Permintaan". Agensi Tenaga Atom Antarabangsa. 2006. Dicapai pada 29 Mac 2007.
- ^ "Perlombongan dan Pemprosesan Uranium di Australia Selatan" . Dewan Perlombongan dan Tenaga Australia Selatan. 2002. Diarkibkan daripada yang asal pada 6 Januari 2012 . Dicapai pada 14 Januari 2007 .
- ^ Ngopana, P.-M.; Felix, B. (2011). Barker, A. (ed.). "Areva menggantung projek lombong uranium CAR" . Berita Republik Afrika Tengah . Dicapai pada 7 Mac 2020 .
- ^ "Kepala Peledak Tentera sebagai Sumber Bahan Api Nuklear" . World-nuclear.org . Dicapai pada 24 Mei 2010 .
- ^ "Megaton kepada Megawatt" . US Enrichment Corp. Diarkibkan daripada yang asal pada 16 Julai 2008.
- ^ "Pemulihan uranium daripada Air Laut" . Institut Penyelidikan Tenaga Atom Jepun. 23 Ogos 1999. Diarkibkan daripada yang asal pada 17 Oktober 2009 . Dicapai pada 3 September 2008 .
- ^ "Berapa lama tenaga nuklear akan bertahan?" . 12 Februari 1996. Diarkibkan daripada yang asal pada 10 April 2007 . Dicapai pada 29 Mac 2007 .
- ^ Tsezos, M.; Noh, SH (1984). "Pengeluaran uranium daripada air laut menggunakan penjerap asal biologi". Jurnal Kejuruteraan Kimia Kanada . 62 (4): 559–561. doi : 10.1002/cjce.5450620416 .
- ^ "Teknologi ORNL menggerakkan saintis lebih dekat untuk mengekstrak uranium daripada air laut" . Makmal Kebangsaan Oak Ridge, Amerika Syarikat. 21 Ogos 2012. Diarkibkan daripada yang asal pada 25 Ogos 2012 . Dicapai pada 22 Februari 2013 .
- ^ "Mengisi tenaga nuklear dengan air laut" . Pnnl.gov. 21 Ogos 2012 . Dicapai pada 22 Februari 2013 .
- ^ "Nilai Pertukaran NUEXCO (Titik Uranium Bulanan)" . Diarkibkan daripada yang asal pada 12 Disember 2007.
- ^ "Pengeluaran Uranium Dunia" . Syarikat Perunding UxC, LLC. Diarkibkan daripada yang asal pada 27 Februari 2007 . Dicapai pada 11 Februari 2007 .
- ^ Mithridates (24 Julai 2008). "Halaman F30: Kazakhstan akan mengatasi Kanada sebagai pengeluar uranium terbesar dunia menjelang tahun lepas (2009)" . Mithridates.blogspot.com . Dicapai pada 12 September 2008 .
- ^ "Kazakistan uranyum üretimini artıracak" . Zaman.com.tr (dalam bahasa Turki). Zaman Gazetesi. 28 Julai 2008. Diarkibkan daripada yang asal pada 13 Januari 2009 . Dicapai pada 12 September 2008 .
- ^ "In Situ Leach Mining (ISL) Uranium – Persatuan Nuklear Dunia" . www.world-nuclear.org . Dicapai pada 6 Mei 2021 .
- ^ "Penemuan Uranium Besar Diumumkan di Somalia" . The New York Times . 16 Mac 1968 . Dicapai pada 16 Mei 2014 .
- ^ "Kekurangan bahan api mungkin mengehadkan pengembangan kuasa nuklear AS" . Institut Teknologi Massachusetts . 21 Mac 2007 . Dicapai pada 29 Mac 2007 .
- ^ Deffeyes, Kenneth S. & MacGregor, Ian D. (Januari 1980). "Sumber Uranium Dunia". Amerika saintifik . 242 (1): 66. Bibcode : 1980SciAm.242a..66D . doi : 10.1038/scientificamerican0180-66 . OSTI 6665051 .
- ^ Kloprogge, J. Theo; Ponce, Concepcion P.; Loomis, Tom A. (2021). Jadual berkala : bahan binaan alam semula jadi : pengenalan kepada unsur-unsur yang wujud secara semula jadi, asal-usulnya dan kegunaannya . Amsterdam: Elsevier. ms 861–862. ISBN 978-0-12-821538-8. OCLC 1223058470 .
- ^ Seaborg 1968 , hlm. 779.
- ^a b c "Bentuk Kimia Uranium". Makmal Kebangsaan Argonne. Diarkibkan daripadayang asalpada 22 September 2006. Dicapai pada 18 Februari 2007.
- ^a b Seaborg 1968, hlm. 778.
- ^a b c d Puigdomenech, Ignasi (2004)Hydra/Medusa Chemical Equilibrium Database and Plotting Software. Institut Teknologi Diraja KTH
- ^a b c d e f g h i j Seaborg 1968, hlm. 782.
- ^a b Seaborg 1968, hlm. 780.
- ^ Beiser, A. (2003). "Transformasi Nuklear" (PDF) . Konsep Fizik Moden (edisi ke-6). Pendidikan McGraw-Hill . ms 432–434. ISBN 978-0-07-244848-1. Diarkibkan daripada yang asal (PDF) pada 4 Oktober 2016 . Dicapai pada 4 Julai 2016 .
- ^ Roederer, IU; Kratz, K.; Frebel, A.; Christlieb, N.; Pfeiffer, B.; Cowan, JJ; Sneden, C. (2009). "Tamat nukleosintesis: Pengeluaran plumbum dan torium dalam galaksi awal". Jurnal Astrofizik . 698 (2): 1963–1980. arXiv : 0904.3105 . Bibcode : 2009ApJ...698.1963R . doi : 10.1088/0004-637X/698/2/1963 . hdl : 2152/35050 . S2CID 14814446 .
- ^a b Kejadian plutonium-244 sebagai nuklida primordial dipertikaikan, walaupun beberapa laporan pengesanannya juga telah dikaitkan dengan runtuhan daripada mediumantara bintang. [115][116]
- ^ Lachner, J.; et al. (2012). "Percubaan untuk mengesan 244 Pu primordial di Bumi". Kajian Fizikal C . 85 (1): 015801. Bibcode : 2012PhRvC..85a5801L . doi : 10.1103/PhysRevC.85.015801 .
- ^ Wallner, A.; Faestermann, T.; Feige, J.; Feldstein, C.; Knie, K.; Korschinek, G.; Kutschera, W.; Ofan, A.; Paul, M.; Quinto, F.; Rugel, G.; Steier, P. (2015). "Kelimpahan 244Pu hidup dalam takungan laut dalam di Bumi menunjukkan kejarangan nukleosintesis aktinida" . Komunikasi Alam Semula Jadi. 6 : 5956. arXiv : 1509.08054 . Bibcode : 2015NatCo...6.5956W . doi : 10.1038/ncomms6956 . ISSN 2041-1723 . PMC 4309418 . PMID 25601158 .
- ^ Marouli, M.; Pommé, S.; Jobbágy, V.; Van Ammel, R.; Paepen, J.; Stroh, H.; Benedik, L. (2014). "Kebarangkalian pelepasan zarah alfa 236 U diperolehi oleh spektrometri alfa". Sinaran Gunaan dan Isotop . 87 : 292–296. doi : 10.1016/j.apradiso.2013.11.020 . ISSN 0969-8043 . PMID 24309010 .
- ^a b Pilihan Jangka Masa Dekat dan Menjanjikan untuk Penggunaan Tenaga Nuklear Berasaskan Thorium(PDF)(Laporan). Vienna: Agensi Tenaga Atom Antarabangsa. 2022.
- ^a b Forsburg, CW; Lewis, LC (24 September 1999). "Kegunaan Untuk Uranium-233: Apa yang Perlu Disimpan untuk Keperluan Masa Depan?" (PDF). Ornl-6952. Makmal Kebangsaan Oak Ridge.
- ^ Goffer, Zvi (2006). Kimia Arkeologi (edisi ke-2). Wiley . hlm. 106. ISBN 978-0-471-91515-7.
- ^ Zhang, ZY; et al. (2021). "Isotop 214 U α -Memancarkan Baharu dan Peningkatan Tidak Normal α -Pengumpulan Zarah dalam Isotop Uranium Teringan" . Surat Semakan Fizikal . 126 (15): 152502. arXiv : 2101.06023 . Kod Bib : 2021PhRvL.126o2502Z . doi : 10.1103/PhysRevLett.126.152502 . PMID 33929212 . S2CID 231627674 . Dicapai pada 15 Mei 2021 .
- ^ Niwase, T.; Watanabe, YX; Hirayama, Y.; et al. (2023). "Penemuan Isotop Baharu 241 U dan Pengukuran Jisim Atom Ketepatan Tinggi Bersistematik Nukleus Pa-Pu Kaya Neutron yang Dihasilkan melalui Tindak Balas Pemindahan Multinukleon". Surat Semakan Fizikal . 130 (13): 132502-1–132502-6. doi : 10.1103/PhysRevLett.130.132502 .
- ^ Mastren, T.; Stein, BW; Parker, TG; Radchenko, V.; Copping, R.; Owens, A.; Wyant, LE; Bugh, M.; Kozimor, SA; Noriter, FM; Birnbaum, ER; John, KD; Fassbender, ME (2018). "Pemisahan protaktinium menggunakan resin kromatografi pengekstrakan berasaskan sulfur" . Kimia Analitik . 90 (11): 7012–7017. doi : 10.1021/acs.analchem.8b01380 . ISSN 0003-2700 . OSTI 1440455 . PMID 29757620 .
- ^ Khuyagbaatar, J.; et al. (11 Disember 2015). "Isotop Jangka Pendek Baharu 221 U dan Permukaan Jisim Berhampiran N = 126" . Surat Semakan Fizikal . 115 (24): 242502. Bibcode : 2015PhRvL.115x2502K . doi : 10.1103/PhysRevLett.115.242502 . PMID 26705628 .
- ^ "Pengayaan Uranium" . Makmal Kebangsaan Argonne. Diarkibkan daripada yang asal pada 24 Januari 2007 . Dicapai pada 11 Februari 2007 .
- ^a b Diehl, Peter. "Uranium Habis: hasil sampingan Rantaian Nuklear". Yayasan Laka. Diarkibkan daripadayang asalpada 13 Januari 2013. Dicapai pada 31 Julai 2009.
- ^ Duarte, FJ ; Hillman, LW, eds. (1990). Prinsip Laser Pewarna . Akademik. hlm. 413. ISBN 978-0-12-222700-4. Diarkibkan daripada yang asal pada 17 September 2010.
- ^ "Asas Radionuklida: Uranium" . Agensi Perlindungan Alam Sekitar AS. 16 Februari 2023 . Dicapai pada 19 April 2023 .
- ^ "ToxFAQ untuk Uranium" . Agensi untuk Bahan Toksik dan Pendaftaran Penyakit. 18 Mac 2014 . Dicapai pada 19 April 2023 .
- ^ "Panduan Poket CDC – NIOSH untuk Bahaya Kimia – Uranium (sebatian tidak larut, sebagai U)" . Institut Keselamatan dan Kesihatan Pekerjaan Negara . 30 Oktober 2019 . Dicapai pada 19 April 2023 .
- ^ Permyakov, Eugene (2009). Metalloproteomik . Hoboken: John Wiley & Sons. hlm. 564. ISBN 978-0-470-44774-1. OCLC 609844907 .
- ^ Busby, C. dan Schnug, E. (2008). "Aspek biokimia dan biofizikal lanjutan pencemaran uranium". Dalam: De Kok, LJ and Schnug, E. (Eds) Beban dan Nasib Uranium Terbitan Baja . Backhuys Publishers, Leiden, Belanda. ISBN 978-90-5782-193-6
- ^ Francis, AJ; Dodge, CJ; McDonald, JA; Halada, GP (2005). "Penyahkotoran permukaan keluli tercemar uranium oleh asid hidroksikarboksilik dengan pemulihan uranium". Sains & Teknologi Alam Sekitar . 39 (13): 5015–21. Bibcode : 2005EnST...39.5015F . doi : 10.1021/es048887c . PMID 16053105 .
- ^ Gandhi, T. Pushparaj; Sampath, Prasanna Venkatesh; Maliyekkal, Shihabudheen M. (15 Jun 2022). "Tinjauan kritikal terhadap pencemaran uranium dalam air bawah tanah: Rawatan dan pelupusan enap cemar". Ilmu Alam Sekitar . 825 : 153947. doi : 10.1016/j.scitotenv.2022.153947 . ISSN 1879-1026 . PMID 35189244 .
- ^ Prusty, Sourav; Somu, Prathap; Sahoo, Jitendra Kumar; Panda, Debasish; Sahoo, Sunil Kumar; Sahoo, Shraban Kumar; Lee, Yong Rok; Jarin, T.; Sundar, L. Syam; Rao, Koppula Srinivas (Disember 2022). "Penyerapan penjerapan uranium (VI) berbahaya daripada sumber air: Kajian menyeluruh". Kemosfera . 308 (Pt 1): 136278. doi : 10.1016/j.chemosphere.2022.136278 . ISSN 1879-1298 . PMID 36057349 .
- ^ Kraf, ES; Abu-Qare, AW; Flaherty, MM; Garofolo, MC; Rincavage, HL & Abou-Donia, MB (2004). "Uranium habis dan semula jadi: kimia dan kesan toksikologi" (PDF) . Jurnal Toksikologi dan Kesihatan Persekitaran Bahagian B: Ulasan Kritikal . 7 (4): 297–317. CiteSeerX 10.1.1.535.5247 . doi : 10.1080/10937400490452714 . PMID 15205046 . S2CID 9357795 .
- ^ Agensi Pendaftaran Bahan Toksik dan Penyakit (ATSDR) (Februari 2013). "2. Perkaitan dengan Kesihatan Awam" (PDF) . Profil Toksikologi untuk Uranium (Laporan). Atlanta, GA: Jabatan Kesihatan dan Perkhidmatan Manusia AS, Perkhidmatan Kesihatan Awam. ms 11–38. CAS# 7440-61-1.
- ^ Hindin, Rita; Brugge, D.; Panikkar, B. (2005). "Teratogenik aerosol uranium yang habis: Kajian semula dari perspektif epidemiologi" . Kesihatan Persekitaran . 4 : 17. doi : 10.1186/1476-069X-4-17 . PMC 1242351 . PMID 16124873 .
- ^ Arfsten, DP; KR Masih; GD Ritchie (2001). "Semakan kesan uranium dan pendedahan uranium yang berkurangan terhadap pembiakan dan perkembangan janin". Toksikologi dan Kesihatan Perindustrian . 17 (5–10): 180–91. doi : 10.1191/0748233701th111oa . PMID 12539863 . S2CID 25310165 .
- ^ Grellier, James; Atkinson, Will; Berard, Philippe; Bingham, Derek; Birchall, Alan; Blanchardon, Eric; Bull, Richard; Guseva Canu, Irina; Challeton-de Vathaire, Cécile; Cokerill, Rupert; Do, Minh T; Inggeris, Hilde; Figuerola, Jordi; Foster, Adrian; Holmstock, Luc; Hurtgen, Kristian; Laurier, Dominique; Penebuk, Matthew; Riddell, Tony; Samson, Eric; Thierry-Chef, Isabelle; Tirmarche, Margot; Vrijheid, Martine; Cardis, Elisabeth (2017). "Risiko kematian kanser paru-paru dalam pekerja nuklear daripada pendedahan dalaman kepada radionuklid pemancar zarah alfa" . Epidemiologi . 28 (5): 675–684. doi : 10.1097/EDE.0000000000000684 . PMC 5540354 . PMID 28520643 .
- ^ "Pernyataan Kesihatan Awam untuk Uranium" (PDF) . CDC . Dicapai pada 5 Mei 2023 .
- ^ Pendedahan Radon kepada Pekerja di Pusat Pengeluaran Bahan Makanan Fernald . Halaman disemak: 8 April 2020. Institut Keselamatan dan Kesihatan Pekerjaan Kebangsaan AS (NIOSH)
- ^ Carta Nuklida, Suruhanjaya Tenaga Atom AS 1968
- ^ Dart, Richard C. (2004). Toksikologi Perubatan . Lippincott Williams & Wilkins. hlm. 1468. ISBN 978-0-7817-2845-4.
- ^a b "Helaian Fakta Sinaran #27, Uranium (U)". Jabatan Kesihatan Negeri Washington, Pejabat Perlindungan Sinaran. 2010. Diarkibkan daripadayang asalpada 28 September 2011. Dicapai pada 23 Ogos 2011.
Rujukan
- Emsley, John (2001). "Uranium" . Blok Binaan Alam Semula Jadi: Panduan A hingga Z untuk Elemen . Oxford : Oxford University Press . ms 476–482 . ISBN 978-0-19-850340-8.
- Seaborg, Glenn T. (1968). "Uranium". Ensiklopedia Unsur Kimia . Skokie, Illinois : Reinhold Book Corporation. ms 773–786. LCCN 68029938 .
Pautan luar
- Data dan analisis bahan api nuklear daripada Pentadbiran Maklumat Tenaga AS
- Harga pasaran semasa uranium
- Peta deposit Uranium Dunia
- Dittmar, William (1888). . Encyclopædia Britannica . Vol. XXIV (edisi ke-9). hlm. 7.
- Bibliografi beranotasi untuk uranium daripada Perpustakaan Digital Alsos
- Bank Data Bahan Berbahaya NLM – Uranium, Radioaktif
- CDC – Panduan Poket NIOSH untuk Bahaya Kimia
- Melombong Uranium di Lombong Langer Heinrich Namibia
- Berita Nuklear Dunia
- Kajian Kes ATSDR dalam Perubatan Alam Sekitar: Ketoksikan Uranium Jabatan Kesihatan dan Perkhidmatan Manusia AS
- Uranium di Jadual Berkala Video (Universiti Nottingham)
- 0001 سورة الفاتحة 👍👍
- 0002 سورة البقرة 👍
- 0003 سورة آل عمران 👍
- 0004 سورة النساء 👍
- 0005 سورة المائدة 👍
- 0006 سورة الأنعام 👍
- 0007 سورة الأعراف 👍
- 0008 سورة الأنفال 👍
- 0009 سورة التوبة 👍
- 0010 سورة يونس 👍
- 0011 سورة هود 👍
- 0012 سورة يوسف 👍
- 0013 سورة الرعد 👍
- 0014 سورة إبراهيم 👍
- 0015 سورة الحجر 👍
- 0016 سورة النحل 👍
- 0017 سورة الإسراء 👍
- 0018 سورة الكهف 👍
- 0019 سورة مريم 👍
- 0020 سورة طه 👍
- 0021 سورة الأنبياء 👍
- 0022 سورة الحج 👍
- 0023 سورة المؤمنون 👍
- 0024 سورة النور 👍
- 0025 سورة الفرقان 👍
- 0026 سورة الشعراء 👍
- 0027 سورة النمل 👍
- 0028 سورة القصص 👍
- 0029 سورة العنكبوت 👍
- 0030 سورة الروم 👍
- 0031 سورة لقمان 👍
- 0032 سورة السجدة 👍
- 0033 سورة الأحزاب 👍
- 0034 سورة سبإ 👍
- 0035 سورة فاطر 👍
- 0036 سورة يس 👍
- 0037 سورة الصافات 👍
- 0038 سورة ص 👍
- 0039 سورة الزمر 👍
- 0040 سورة غافر 👍
- 0041 سورة فصلت 👍
- 0042 سورة الشورى 👍
- 0043 سورة الزخرف 👍
- 0044 سورة الدخان 👍
- 0045 سورة الجاثية 👍
- 0046 سورة الأحقاف 👍
- 0047 سورة محمد 👍
- 0048 سورة الفتح 👍
- 0049 سورة الحجرات 👍
- 0050 سورة ق 👍
- 0051 سورة الذاريات 👍
- 0052 سورة الطور 👍
- 0053 سورة النجم 👍
- 0054 سورة القمر 👍
- 0055 سورة الرحمن 👍
- 0056 سورة الواقعة 👍
- 0057 سورة الحديد 👍
- 0058 سورة المجادلة 👍
- 0059 سورة الحشر 👍
- 0060 سورة الممتحنة 👍
- 0061 سورة الصف 👍
- 0062 سورة الجمعة 👍
- 0063 سورة المنافقون 👍
- 0064 سورة التغابن 👍
- 0065 سورة الطلاق 👍
- 0066 سورة التحريم 👍
- 0067 سورة الملك 👍
- 0068 سورة القلم 👍
- 0069 سورة الحاقة 👍
- 0070 سورة المعارج 👍
- 0071 سورة نوح 👍
- 0072 سورة الجن 👍
- 0073 سورة المزمل 👍
- 0074 سورة المدثر 👍
- 0075 سورة القيامة 👍
- 0076 سورة الإنسان 👍
- 0077 سورة المرسلات 👍
- 0078 سورة النبإ
- 0079 سورة النازعات 👍
- 0080 سورة عبس 👍
- 0081 سورة التكوير 👍
- 0082 سورة الإنفطار 👍
- 0083 سورة المطففين 👍
- 0084 سورة الإنشقاق 👍
- 0085 سورة البروج 👍
- 0086 سورة الطارق 👍
- 0087 سورة الأعلى 👍
- 0088 سورة الغاشية 👍
- 0089 سورة الفجر 👍
- 0090 سورة البلد 👍
- 0091 سورة الشمس 👍
- 0092 سورة الليل 👍
- 0093 سورة الضحى 👍
- 0094 سورة الشرح 👍
- 0095 سورة التين 👍
- 0096 سورة العلق 👍
- 0097 سورة القدر 👍
- 0098 سورة البينة 👍
- 0099 سورة الزلزلة 👍
- 0100 سورة العاديات 👍
- 0101 سورة القارعة 👍
- 0102 سورة التكاثر 👍
- 0103 سورة العصر 👍
- 0104 سورة الهمزة 👍
- 0105 سورة الفيل 👍
- 0106 سورة قريش 👍
- 0107 سورة الماعون 👍
- 0108 سورة الكوثر 👍
- 0109 سورة الكافرون 👍
- 0110 سورة النصر 👍
- 0111 سورة المسد 👍
- 0112 سورة الإخلاص 👍
- 0113 سورة الفلق 👍
- 0114 سورة الناس 👍


![Pengeluaran uranium dunia (lombong) dan permintaan[81]](https://upload.wikimedia.org/wikipedia/commons/thumb/7/75/U_production-demand.png/431px-U_production-demand.png)

![Pengeluaran uranium 2015, dalam tan[85]](https://upload.wikimedia.org/wikipedia/commons/thumb/9/9a/Uranium_production%2C_OWID.svg/425px-Uranium_production%2C_OWID.svg.png)
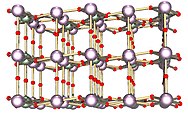
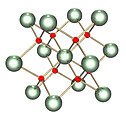

Comments
Post a Comment